
工业上消除氮氧化物的污染可用如下反应:
CH4(g)+2NO2(g)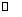 N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g) 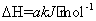
在温度T1和T2时,分别将0.50molCH4和1.2molNO2充入体积为1L的恒容密闭容器中,测得n(N2)随时间变化的数据如下表:
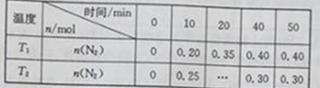
下列说法不正确的是
A. 10min内,T1时的v(N2)比T2时的小
B. T1<T2
C. a<0
D. T2时,若向平衡后的容器中再充入1.2molCH4,重新达到平衡时n(N2)=0.40mol
【知识点】化学平衡的影响因素 G5
【答案解析】D 解析:A.10 min内,T1时υ(N2)=0.20mol/1L/10min=0.020mol•L-1•min-1,T2时υ(N2)=0.25mol/1L/10min=0.025mol•L-1•min-1,T1时υ(CH4)比T2时小,故A正确;温度升高,反应速率加快,因此T2>T1,故B正确; C.温度升高,甲烷剩余量增多,说明反应向左进行,正反应放热,所以a<0,故C正确;
D.对于反应 CH4(g)+2NO2(g)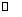 N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g)
开始:0.5mol 1.2mol
转化: 0.3mol 0.6mol 0.3mol 0.3mol o.6mol
平衡时:0.2mol 0.6mol 0.3mol 0.3mol o.6mol
容器的体积是1L,可以计算得到在T2时化学平衡常数为0.45,当向平衡后的容器中再充入1.2molCH4时,设达到平衡时n(N2)为0.40mol,则
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g)
开始:1.7mol 1.2mol
转化:0.40mol 2×0.40mol 0.40mol 0.40mol 2×0.40mol
平衡时:1.3 mol 0.4mol 0.40mol 0.40mol 2×0.40mol
带入到平衡常数的计算公式中与上述平衡常数不等,故重新达到平衡时n(N2)不是0.40mol,错误。
【思路点拨】本题主要考查外界条件对化学反应速率以及平衡移动原理及其应用,难度中等以上,注意灵活运用所学知识。


科目:高中化学 来源: 题型:
“神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料。甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料。下列说法中错误的是( )

A.甲物质可以在引发剂作用下生成有机高分子化合物
B.1 mol乙物质可与2 mol钠完全反应生成1 mol氢气
C.丙物质能使酸性高锰酸钾溶液褪色
D.甲、乙、丙三种物质都可以发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
铅蓄电池是典型的可充电型电池,它的正负极极板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO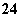
 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
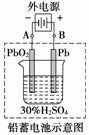
(1)放电时:正极的电极反应式是____________________________________________;
电解液中H2SO4浓度将变____;电流方向从____极流向____极。当外电路通过1 mol电子时,理论上负极板的质量增加________g。
(2)在完全放电耗尽PbO2和Pb时,若按如图连接,电解一段时间后,则在A电极上生成______、B电极上生成________,此时铅蓄电池的正负极的极性将________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各种方法中,能对金属起到防止或减缓腐蚀作用的是( )
①金属表面涂抹油漆 ②改变金属内部结构 ③保持金属表面清洁干燥 ④金属表面进行电镀 ⑤使金属表面形成致密的氧化物薄膜
A.①②③④ B.①③④⑤ C.①②④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
如何防止铁的锈蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
| 序号 | 内容 | 实验现象 |
| 1 | 常温下将铁丝放在干燥空气中一个月 | 干燥的铁丝表面依然光亮 |
| 2 | 常温下将铁丝放在潮湿空气中一小时 | 铁丝表面依然光亮 |
| 3 | 常温下将铁丝放在潮湿的空气中一个月 | 铁丝表面已变得灰暗 |
| 4 | 将潮湿的铁丝放在常温的氧气流中一小时 | 铁丝表面略显灰暗 |
| 5 | 将潮湿的铁丝放在高于常温的氧气流中一小时 | 铁丝表面已变得灰暗 |
| 6 | 将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时 | 铁丝表面灰暗程度比实验5严重 |
回答以下问题:
(1)上述实验中发生了电化学腐蚀的是(填实验序号)____________;在电化学腐蚀中,负极反应是_________________________________________________________________;
正极反应是__________________________________________________________;
(2)由该实验可知,可以影响铁锈蚀速率的因素是
________________________________________________________________________;
(3)为防止铁的锈蚀,工业上普遍采用的方法是____________________(答两种方法)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
H2NOONH4(s)  2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
| 温度( | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度( | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
氨基甲酸铵分解反应的焓变 H__________0(填“>”、“<”或“=”)
H__________0(填“>”、“<”或“=”)
可以判断该分解反应已经达到化学平衡的是____________.(填字母)
A. 2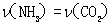
B. 密闭容器中总压强不变
C. 密闭容器中混合气体的密度不变
D. 密闭容器中氨气的体积分数不变
根据表中数据,计算25.0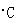 时的分解平衡常数为____________.
时的分解平衡常数为____________.
(2) 25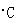 时,NH3·H2O电离常数Kb=1.8
时,NH3·H2O电离常数Kb=1.8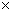 10-5,Mg(OH)2的溶度积常数Ksp=1.8
10-5,Mg(OH)2的溶度积常数Ksp=1.8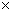 10-11,计算0.5mol/L氨水的pH约为__________.(已知lg3
10-11,计算0.5mol/L氨水的pH约为__________.(已知lg3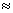 0.5)
0.5)
在某氯化镁溶液中加入一定量的某浓度的氨水后,测得混合液PH=11,则此温度下残留在溶液中的c(Mg2+)=_________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 B、C、D、E五种短周期元素,元素A最外层电子数与其周期数相等,A与C可形成A2C2和A2C两种化合物,B的最高价氧化物对应的水化物与气体BA3化合生成乙,D+与C2-具有相同的电子数,E元素最高化合价与最低化合价代数和为6。
请回答下列问题:
(1) C在元素周期表中的位置为____________。写出BA3的电子式_______________。
(2)上述元素中,原子半径最大的是____________________(写元素符号)。最高价氧化物对应的水化物中酸性最强的酸是__________________(写化学式)。
(3)化合物乙的水溶液呈酸性,请用离子方程式表示__________________。
(4) A、C、E三种元素按原子个数比1:1:1组成的化合物与BA3反应生成B的单质,写出该反应的化学方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是中学化学常见的四种物质,它们之间具有如图所示转化关系,则下列组合不可能的是 ( )
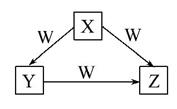
| X | Y | Z | W | |
| A | C | CO | CO2 | O2 |
| B | Na | Na2O | Na2O2 | O2 |
| C | AlCl3 | Al(OH)3 | NaAlO2 | NaOH |
| D | Fe | FeCl2 | FeCl3 | Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验操作、现象和解释或结论都正确的是
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
【知识点】化学实验
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com