
下列图示与对应的叙述相符的是
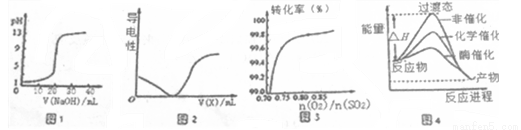
A.图一表示0.1000mol·L-1NaOH溶液滴定20.00ml 0.1000 mol·L-1醋酸溶液得到滴定曲线
B.图2所示在H2S溶液导电性实验中,曲线可确定通入的气体X为Cl2
C.图3在其它条件不变时,2SO2(g)+O2(g)  2SO3(g)转化关系中,纵坐标表示O2的转化率
2SO3(g)转化关系中,纵坐标表示O2的转化率
D.由图4所示曲线可知,酶催化比化学催化的效果好
【答案】D
【解析】
试题分析:A.醋酸是弱酸,0.1mol/L的醋酸的pH>1,所以图一表示0.1000mol·L-1NaOH溶液滴定20.00ml 0.1000 mol·L-1一元强酸溶液得到滴定曲线,错误;B.在H2S的溶液中通入Cl2,会发生反应:Cl2+H2S=S↓+2HCl,溶液的酸性增强,离子浓度增大,溶液的导电性增强,与图像不吻合,错误;C.2SO2(g)+O2(g)  2SO3(g)是可逆反应,在其它条件不变时,增大氧气的浓度,化学平衡正向移动,但是O2的转化率会降低,不符合图像,错误;D.催化剂可以降低反应的活化能,使反应速率加快,反应需要的活化能越低,反应速率就越快。根据图示可知酶催化比化学催化的效果好,正确。
2SO3(g)是可逆反应,在其它条件不变时,增大氧气的浓度,化学平衡正向移动,但是O2的转化率会降低,不符合图像,错误;D.催化剂可以降低反应的活化能,使反应速率加快,反应需要的活化能越低,反应速率就越快。根据图示可知酶催化比化学催化的效果好,正确。
考点:考查图像方法在溶液的导电性、化学反应及催化剂的作用比较的应用的知识。
【题型】选择题
【适用】较难
【标题】【百强校】2015-2016学年陕西西安高新一中高一下期末化学试卷(带解析)
【关键字标签】
【结束】
已知:① 2CO(g)+O2(g) 2CO2(g) △H=-566kJ/mol;
2CO2(g) △H=-566kJ/mol;
②Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g) △H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是

A.CO(g)与Na2O2(s)反应放出509kJ热量时,消耗的CO是28g
B.如上图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) △H<-452 kJ/mol
D.CO的燃烧热为-566 kJ/mol
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源:2015-2016学年江西省高二下学期期末考试化学试卷(解析版) 题型:选择题
某有机物的氧化产物甲和还原产物乙都能与金属钠反应放出H2,甲、乙反应可生成丙,甲、丙都能发生银镜反应,此有机物是 ( )
A.乙酸 B.乙醛 C.甲酸 D.甲醛
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆一中高一下期末化学试卷(解析版) 题型:推断题
X、Y、Z、P、Q、W、R、T是元素周期表短期中最常见的主族元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
X | 某一种同位素,可被用作相对原子质量的标准 |
Y | 其最高价氧化物对应水化物能与其气态氢化物相互间发生化合反应 |
P | 是短周期中(除稀有气体外)原子半径最大的元素 |
Q | 存在质量数为25,中子数为13的核素 |
W | 位于周期表第13列 |
R | 与Z同族,且最高价氧化物对应水化物的浓溶液常温下与W单质会出现钝化现象 |
(1)R在元素周期表中的位置为__________;将Q、W、Z、Y的简单离子的半径从大到小排序__________________________(用离子符号表示)
(2)T的单质易溶于XT4中,理由是______________________________________。
(3)根据下表中的信息,判断下列化合物固态的晶体类型(填“离子晶体”……等);)
化合物 | X3Y4 | R2T2 |
晶体类型 |
|
|
熔点/°C | >3600 | -76 |
(4)任意写出一个由Y、Z元素分别与氢元素形成的10电子粒子间相互反应的离子方程式:
_________________________________________________________________________。
(5)在25°C、10kPa下,已知13.5g的W固体单质在Z2气体中完全燃烧后恢复至原状态,放热419kJ,写出表示W单质燃烧热的热化学方程式______________________________。
(6)化合物P2R溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构相似的物质P2R2,其溶液显黄色,则P2R2的电子式为___________,用化学方程式表示P2R溶液在空气中的变质过程________.
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安高新一中高一下期末化学试卷(解析版) 题型:填空题
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)已知:2NO2(g)  N2O(g) △H1 2NO2(g)
N2O(g) △H1 2NO2(g)  N2O(l) △H2
N2O(l) △H2
下列能量变化示意图中,正确的是(选填字母) 。

(2)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如下图)
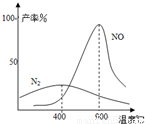
温度较低时以生成 为主,温度高于900℃时,NO产率下降的原因是 。
(3)火箭升空需要高能的燃料,经常是用四氧化二氮和联氨(N2H4)作为燃料,工业上利用氨气和氢气可以合成氨气,氨又可以进一步制备联氨等。
已知:N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ•mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534.0kJ•mol-1
NO2(g)  1/2 N2O4(g) △H=-26.35kJ•mol-1
1/2 N2O4(g) △H=-26.35kJ•mol-1
①写出气态联氨在气态四氧化二氮中燃烧生成氮气和水蒸气的热化学方程式: 。
②用氨和次氯酸钠按一定物质的量之比混合反应可生成联氨,该反应的化学方程式为 。
【答案】(1)A;(2)N2 ;氨气转化为一氧化氮的反应为放热反应;
(3)①2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=-1083kJ/mol;②2NH3+NaClO=N2H4+NaCl+H2O。。
【解析】
试题分析: 2NO2(g)  N2O4(g) △H<0,由于同一物质在气体时含有的能量比液体或固体时多,所以A.可以正确的表示反应过程的能量变化,B、C不能正确的表示物质的能量与状态及反应过程的能量变化关系;(2)根据图示可知在低温时主要从事N2;温度高于900℃时,NO产率下降的原因是氨气转化为一氧化氮的反应为放热反应,根据平衡移动原理,升高温度,化学平衡向吸热的逆反应方向移动,所以NO的产率降低;(3)①已知:N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ•mol-1 ① N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534.0kJ•mol-1② NO2(g)
N2O4(g) △H<0,由于同一物质在气体时含有的能量比液体或固体时多,所以A.可以正确的表示反应过程的能量变化,B、C不能正确的表示物质的能量与状态及反应过程的能量变化关系;(2)根据图示可知在低温时主要从事N2;温度高于900℃时,NO产率下降的原因是氨气转化为一氧化氮的反应为放热反应,根据平衡移动原理,升高温度,化学平衡向吸热的逆反应方向移动,所以NO的产率降低;(3)①已知:N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ•mol-1 ① N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534.0kJ•mol-1② NO2(g)  1/2 N2O4(g) △H=-26.35kJ•mol-1③根据盖斯定律,②×2-①-③×2得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=-1083kJ/mol;②氨和次氯酸钠反应时,氨气中的氮元素被氧化为N2H4,NaClO中的氯元素被还原为NaCl,根据电子守恒、原子守恒,可得该化学方程式为:2NH3+NaClO=N2H4+NaCl+H2O。
1/2 N2O4(g) △H=-26.35kJ•mol-1③根据盖斯定律,②×2-①-③×2得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=-1083kJ/mol;②氨和次氯酸钠反应时,氨气中的氮元素被氧化为N2H4,NaClO中的氯元素被还原为NaCl,根据电子守恒、原子守恒,可得该化学方程式为:2NH3+NaClO=N2H4+NaCl+H2O。
考点:考查图像方法在热化学方程式的应用、热化学方程式和化学方程式的书写的知识。
【题型】填空题
【适用】较难
【标题】【百强校】2015-2016学年陕西西安高新一中高一下期末化学试卷(带解析)
【关键字标签】
【结束】
将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2  2SO3(正反应放热),反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热),反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是______。(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)求该反应达到平衡时SO2的转化率______(用百分数表示)。(写出计算过程)
(3)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?(写出计算过程)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安高新一中高一下期末化学试卷(解析版) 题型:选择题
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性.下列说法正确的是
A. X、Y、Z、W的原子半径依次减小
B. 若W与Y的原子序数相差5,则二者形成化合物的化学式可能为Y2W3
C. W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D. W与X形成的化合物只含离子键
【答案】A
【解析】试题分析:W、X、Y、Z为短周期元素,W、Z同主族,W的气态氢化物的稳定性比Z的气态氢化物的稳定性强,故W、Z为非金属,原子序数Z>W,W处于第二周期,Z处于第三周期,X、Y、Z同周期,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,则原子序数Y>X,且二者处于第三周期,X、Y、Z的原子序数Z>Y>X。A.W、Z同主族,原子序数Z>W,X、Y、Z同周期,X、Y、Z的原子序数Z>Y>X,所以原子半径X>Y>Z>W,正确;B.若W为N元素,Y为Mg元素,二者的原子序数相差5,二者形成化合物的化学式可能为Mg3N2,为Y3W2,错误;C.W的气态氢化物为氨气、水、氟化氢时,分子间存在氢键,沸点高于同族其它氢化物的沸点,W为C、Z为Si时,W氢化物沸点较低,错误;D.若W与X形成的化合物为过氧化钠,既含离子键又含共价键,错误。
考点:考查元素周期表、元素周期律的应用的知识。
【题型】选择题
【适用】一般
【标题】【百强校】2015-2016学年陕西西安高新一中高一下期末化学试卷(带解析)
【关键字标签】
【结束】
气相直接水合法制乙醇的方程式为:C2H4 (g)+H2O(g)=C2H5OH(g),其中乙烯的平衡转化率与温度、压强的关系如图[起始n(H2O)︰n(C2H4)=1︰1]。
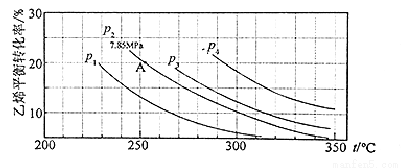
计算乙烯水合制乙醇反应在图中A点的平衡常数KP为(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
A.0.068 MPa-1 B.0.082 C.0.072 MPa-1 D.0.082 MPa-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安高新一中高一下期末化学试卷(解析版) 题型:选择题
已知:①2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H1
②2CO(g)+O2(g)=2CO2(g) △H2
③2H2(g)+O2(g)=2H2O(l) △H3
④2H2(g)+O2(g)=2H2O(g) △H4
⑤CO(g)+2H2(g)=CH3OH(g) △H5
下列关于上述反应焓变的判断正确的是
A.△H1>0,△H2<0
B.△H3>△H4
C.△H1=△H2+2△H3-△H5
D.2△H5+△H1<0
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安高新一中高一下期末化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.研究物质在水溶液中的反应,溶液是环境,盛溶液的烧杯和溶液之外的空气等便是体系
B.能源的开发和利用可以用来衡量一个国家或地区的经济发展和科学技术水平
C.催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加
D.在稀溶液中,H+(aq) +OH-(aq)=H2O(l) △H=-57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1mol KOH的溶液混合,放出的热量大于57.3kJ
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期末化学试卷(解析版) 题型:选择题
几种短周期元素的原子半径及主要化合价见下表:
元素代号 | K | L | M | Q | R | T | N |
原子半径/nm | 0.183 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
主要化合价 | +1 | +2 | +3 | +6、-2 | +2 | -2 | +1 |
下列叙述正确的是
A.K、L、M三元素的金属性逐渐增强
B.在RCl2分子中,各原子均满足8电子的稳定结构
C.Q元素的最高价氧化物为电解质,其水溶液能够导电
D.K在T单质中燃烧所形成的化合物中含有非极性共价键和离子键
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南琼海嘉积中学高一下期末文科化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.需要加热的化学反应都是吸热反应
B.中和反应都是放热反应
C.原电池是将电能转化为化学能的一种装置
D.水力发电是将化学能转化为电能的过程
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com