
【题目】如图是某只含C、H、O三种元素的有机物分子的球棍模型。关于该物质的说法正确的是
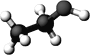
A.分子式为CH3COOH
B.能用于萃取碘水中的单质碘
C.能使紫色石蕊试液变红色
D.能与金属钠反应生成氢气
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】已知在1×103Pa、298K条件下,4g氢气燃烧生成水蒸汽放出484kJ热量,下列热化学方程式正确的是
A.H2O(g)=H2(g)+![]() O2(g) △H=+242 kJ·mol-1
O2(g) △H=+242 kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) △H=-484 kJ·mol-1
C.H2(g)+![]() O2(g)= H2O(l) △H=-242 kJ·mol-1
O2(g)= H2O(l) △H=-242 kJ·mol-1
D.H2O(l)=2H2(g)+O2(g) △H=+484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5流程:
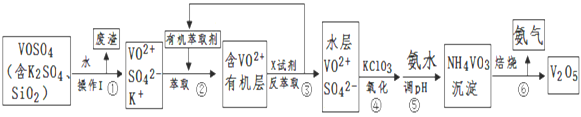
(1)步骤①所得废渣的成分是____________(写化学式),操作I的名称__________;
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n (水层)+ 2nHA(有机层)![]() 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是_____________________________;
③中X试剂为(写化学式)______________________________________;
(3)④的离子方程式为 ___________________________________________;
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为____________;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< _____________;(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有__________和_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/LHCl溶液40mL,溶液中含碳元素的各种微粒(CO2逸出未画出)的物质的量分数随溶液pH变化的部分情况如图所示,下列说法错误的是( )
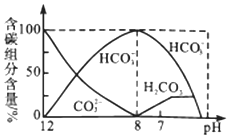
A.在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存
B.已知在25℃,CO32-的水解平衡常数Kh1=2×10-4,当溶液的pH=10时,溶液中c(HCO3-):c(CO32-)=2:1
C.pH=7时溶液中各种离子其物质的量浓度的大小关系是c(Na+)>c(HCO3-)>c(Cl-)>c(H+)=c(OH-)>c(CO32-)
D.当混合液pH≈6时,开始放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)某同学测量强酸和强碱的中和热,将50.0 mL 0.10 mol·L-1 H2SO4溶液与50.0 mL 0.22 mol·L-1 NaOH溶液混合,放出0.572kJ热量,该反应的中和热为______________,用离子方式表示该反应中和热的热化学方程式:_________________________________________。
(2)已知:H2(g)+![]() O2(g)=H2O(g),反应过程中能量变化如图所示
O2(g)=H2O(g),反应过程中能量变化如图所示
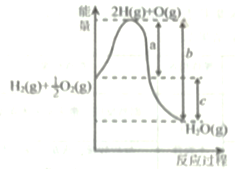
已知:a、b、c表示数值(均为正数),下列对a、b、c说法正确的是_____。
A.a表示此反应正反应速率的活化能。
B.![]() 表示O-H键的键能
表示O-H键的键能
C.c表示此反应的反应热△H
D.b表示1摩尔H2O(g)具有的内能
(3)SF6是一种优良的绝缘气体,分子结构中,只存在S-F键,已知1 mol S(s)转化为气态硫原子吸收能量280kJ,F-F键能为160 kJ·mol-1,S-F键能为330 kJ·mol-1,试写出S(s)和F2(g)反应生成SF6(g)的热化学方程式______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2CO3和H2C2O4都是二元弱酸,不同pH环境下它们不同形态的粒子的组成百分率如图所示:下列说法正确的是( )
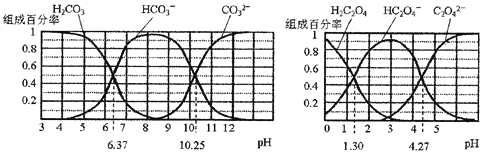
A.在pH为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
B.反应 HCO3-+H2O![]() H2CO3+OH-的平衡常数为
H2CO3+OH-的平衡常数为![]()
C.0.1 mol/L NaHC2O4溶液中c(C2O4-)+c(H2C2O4)=0.1 mol/L
D.往Na2CO3溶液中加入少量草酸溶液,发生反应:CO32-+H2C2O4=HCO3-+ HC2O4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列有关说法正确的是_________________。
A.用金属的电子气理论能合理地解释金属易腐蚀的原因
B.手性催化剂只催化或者主要催化一种手性分子的合成
C.草酸二甲酯分子中σ键和π键个数比为6:1
D.MgCO3的热稳定性强于BaCO3
E.根据火山喷出的岩浆中冷却时ZnS比HgS先析出,能判断ZnS的晶格能大于HgS
(2)已知SbCl3、SbCl5、SnCl4的熔点依次为73.5℃、2.8℃、-33℃。依据上述实验事实回答:
①SnCl4中Sn的杂化类型为________,SbCl5的晶体类型为_______,SbCl3的空间构型为____________。
②实验测得在极性溶剂中SbCl5的溶解度比SbCl3的溶解度小得多,其主要原因是___________。
(3)人们一直致力于人工固氮的研究,以获得廉价的氮肥。科学家先后提出并合成了固氮酶的多种模拟物。其中一类是含Mo(钼)、Fe、S原子的类立方体结构,如下图所示:
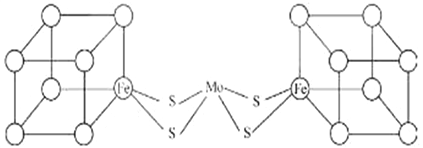
图中所有实线均代表化学键,左右两边对称,各含一个类立方体的结构。每个类立方体含有4个Fe原子、4个S原子,它们位于立方体的8分顶点,且同种原子不相邻。(已知元素电负性分别为:S—2.5 Fe—1.8 Mo—1.8)
①Mo与Cr是同族元素,并且位于相邻周期,写出基态Mo原子的价电子的轨道表达式为_____________。
②钼是一种人体必需的微量元素。工业上可用辉钼矿(MoS2)焙烧除硫得三氧化钼,写出该过程的化学方程式___________________。
③上述一个类立方体中4个Fe原子所在的顶点连接所构成的空间几何体为_____________。
④在类立方体结构中,一种最近的S原子和S原子间距离为apm,该结构的密度为_______g/cm3(已知NA,只需列式,无需化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物有着十分重要的用途:如氨基乙酸铜[结构简式为(H2NCH2COO)2Cu]常用作食品补铜剂及矿物元素饲料添加剂,硒化铜纳米晶在光电转化中有着广泛地应用;硫酸铜可用作配制农药等。
(1)基态硒原子的电子排布式为____,基态氮原子电子的空间运动状态有__种,与硒同周期相邻的三种元素第一电离能由大到小的顺序为______
(2)(H2NCH2COO)2Cu氨基乙酸铜中,碳原子的杂化轨道类型是______;与氮原子成键的原子(含氮原子本身)形成的空间构型是__________。
(3)硫酸铜晶体的组成可表示为[Cu(H2O)4]SO4·H2O,实验测得该物质中存在氢键且水分子成“键”情况与冰中类似,则1mol[Cu(H2O)4]SO4·H2O中氢键数目为__NA。
(4)硫酸铜在高温下分解有可能得到CuO、Cu2O、SO2、SO3等物质,其中CuO的熔点为1026℃。
①CuO的晶体类型是_____,熔点Cu2O>Cu2S的原因是______
②SO2与SO3中,属于非极性分子的是__,SO2在溶剂水与溶剂CCl4中,相同温度能溶解更多SO2的溶剂是___________
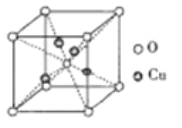
③铜的某种氧化物的晶胞如下图所示,则该氧化物的化学式为_______,若组成粒子氧、铜的半径分别为rOpm、rCupm,密度ρg/cm3,阿伏加德罗常数值为NA,则该晶胞的空间利用率为______(用含π的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.一定温度下,在容积为V L的密闭容器中进行aN(g)![]() bM(g)的放热反应,M、N物质的量随时间的变化曲线如图所示:
bM(g)的放热反应,M、N物质的量随时间的变化曲线如图所示:

(1)此反应的化学方程式中![]() =______。
=______。
(2)t2时两线交叉点__平衡状态(填“是”或“不是”),v正__v逆(填“>”“<” 或“=”)。
(3)此反应达到平衡时,反应物的转化率为____________。
(4)下列描述能说明上述反应达到平衡状态的是__________。
①反应中M与N物质的量之比为2∶5;②混合气体的总物质的量不随时间的变化而变化;③M的转化率达到最大;④如容器为绝热容器,体系内温度不再变化。
II.某温度时,把1 mol N2O4气体通入体积为10 L的真空密闭容器中,立即出现红棕色[因为发生N2O4(无色) ![]() 2NO2(红棕色)的反应],反应进行4 s时,NO2的浓度为0.04mol·L-1,再经过一段时间后反应达到平衡状态,这时容器内压强为开始时的1.8倍,则
2NO2(红棕色)的反应],反应进行4 s时,NO2的浓度为0.04mol·L-1,再经过一段时间后反应达到平衡状态,这时容器内压强为开始时的1.8倍,则
(1)前4 s以N2O4浓度变化表示的平均反应速率为________________。
(2)在4 s末时容器内的压强是开始时的___________倍。
(3)平衡时容器内NO2的浓度是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com