
| A. | Na、Mg、Al | B. | N、P、As | C. | P、Si、Al | D. | C、Si、P |
分析 同周期自左而右原子半径减小,同主族自上而下原子半径增大,一般电子层越大原子半径越大.
解答 解:A.同周期自左而右原子半径减小,故原子半径Na>Mg>Al,故A正确;
B.同主族自上而下原子半径增大,故原子半径N<P<As,故B错误;
C.同周期自左而右原子半径减小,故原子半径P<Si<Al,故B错误;
D.同周期自左而右原子半径减小,同周期自左而右原子半径减小,一般电子层越大原子半径越大,故原子半径Si>P>C,故D错误.
故选:A.
点评 本题考查原子半径的大小比较,是对元素周期律的应用,从结构上理解微粒半径大小比较,题目主要涉及同主族、同周期比较以及短周期元素比较,注意Cl、Li原子半径.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | E(4s)>E(3d) | B. | E(6p)>E(5f) | C. | E(6s)<E(5p) | D. | E(4d)<E(5p) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA | |
| C. | 28g乙烯所含共用电子对数目为4NA | |
| D. | 1mol甲基的电子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤素单质的最外层电子数都是7 | |
| B. | 从上到下,卤素原子的电子层数依次增多,半径依次减小 | |
| C. | 从F到I,原子核对最外层电子的吸引能力依次减弱,原子的得电子能力依次减弱 | |
| D. | 卤素单质与H2化合由易到难顺序为F2<Cl2<Br2<I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y>X>Z>W | B. | W>X>Z>Y | C. | X>Y>Z>W | D. | Y>Z>X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
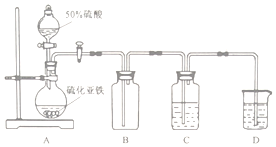
| 硫质量分数/% | 总铁质量分数/% | 亚铁质量分数/% | 硫化亚铁质量分数/% |
| 22.00 | 44.60 | 38.50 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:1 | C. | 2:3 | D. | 4:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com