
| A. | 工业上通过电解氯化钠溶液制取金属钠 | |
| B. | 金属镁在空气燃烧后的产物除MgO外,还有Mg3N2和C等 | |
| C. | 钠钾合金可在快中子反应堆中作热交换剂 | |
| D. | 钠可用于从钛、铌等金属的氯化物中置换出金属单质 |
分析 A、应电解熔融的氯化钠;
B、镁在空气中燃烧和氧气反应生成氧化镁,和氮气反应生成氮化镁,和二氧化碳反应生成氧化镁和碳;
C、钠钾合金作反应堆中的热交换剂;、
D、Na的还原性很强,能从钛、锆等金属的氯化物中置换出钛、锆等单质.
解答 解:A、要得到钠和氯气需要电解熔融的NaCl,电解饱和食盐水生成氯气、氢气和氢氧化钠,故A错误;
B、镁在空气中燃烧和氧气反应生成氧化镁,和氮气反应生成氮化镁,和二氧化碳反应生成氧化镁和碳,金属镁在空气燃烧后的产物除MgO外,还有Mg3N2和C等,故B正确;
C.钠钾合金为液态,可在中子反应堆作热交换剂,故C正确;
D.钠可用于从钛、铌等金属的氯化物中置换出金属单质,故D正确;
故选A.
点评 本题主要考查了钠的性质与用途,注意知识的积累,物质应用取决于性质,掌握基础是关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 相同体积、相同pH的三种溶液:①CH3COOH、②HCl、③H2SO4,中和NaOH的物质的量由大到小的顺序是:①>③>② | |
| B. | NaHCO3溶液中有:c(Na+)+c(H+)═c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | 相同浓度的下列溶液:①CH3COONH4、②CH3COONa、③CH3COOH中,c(CH3COO-)由大到小的顺序是:②>①>③ | |
| D. | pH=4的Al2(SO4)3溶液中,水电离出H+的物质的量浓度为10-10mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
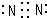 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H、D、T互为同素异形体 | B. | 乙醇的分子式:C2H6O | ||
| C. | NH4Cl的电子式: | D. | 羟基的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将0.1mol的镁、铝混合物溶于100mL 4mol/LHCl溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL 4mol/LHCl溶液中,然后再滴加1mol/L NaOH溶液.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 次氯酸钠溶液与醋酸溶液混合:ClO-+H+═HClO | |
| C. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+ $\frac{\underline{\;\;△\;\;}}{\;}$ Fe3++3NO2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 96倍 | B. | 48倍 | C. | 12倍 | D. | 32倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,X分子的空间构型为三角锥形.
,X分子的空间构型为三角锥形.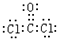 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com