
| A.若混合前三种溶液pH相等,将它们同等倍数稀释后,则KOH溶液pH最大 |
| B.若混合前三种溶液物质的量浓度相等,混合后溶液呈中性,则V1>V2>V3 |
| C.若混合前三种溶液物质的量浓度相等,混合后恰好完全中和,则V1>V2>V3 |
| D.若混合前三种溶液pH相等,混合后恰好完全中和,则V1>V2>V3 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.自来水 | B.0.5 mol/L盐酸 |
| C.0.5 mol/L醋酸 | D.0.5 mol/L mol·Lˉ1氨水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 无机酸 | 氢氰酸(HCN) | 碳酸(H2CO3) | 氢氟酸(HF) |
| 电离平衡常数K值 | 6.2×10—10(K) | 4.2×10—7(K1) 5.6×10—11(K2) | 6.61×10—4(K) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.V3>V2>V1 | B.V1=V2=V3 |
| C.V3>V2=V1 | D.V1=V2>V3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.含有1 mol NH3分子? | B.含NH3和NH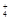 之和为1 mol? 之和为1 mol? |
| C.含NH3·H2O 1 mol? | D.含NH3、NH3·H2O、NH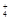 之和为1 mol 之和为1 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH3COONa溶液中:c(Na+) = c(CH3COO-) |
| B.pH=3的醋酸溶液加水稀释过程中:溶液中各离子浓度均变小 |
| C.pH相同的NaOH溶液与NaHCO3溶液中:水的电离程度相同 |
| D.pH=9的NaHX溶液中: c(H2X)>c(X2-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电解质在溶液里达到电离平衡时,分子的浓度和离子的浓度相等 |
| B.电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是静态平衡 |
| C.电离平衡是相对的、暂时的,外界条件改变时,平衡就会发生移动 |
| D.电解质达到电离平衡后,各种离子的浓度相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.相同浓度的两溶液中c(H+)相同 |
| B.100mL0.1mol/L的两溶液能中和等物质的量的氢氧化钠 |
| C.pH=3的两溶液都稀释10倍,盐酸的pH大于醋酸的PH |
| D.两溶液中分别加人少量对应的钠盐,c(H+)均明显减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | ① | ② | ③ | ④ |
| pH | 12 | 12 | 2 | 2 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com