
【题目】用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.常温常压下,1mol丙烷共用电子对数为10 NA
B.0.5 mol甲烷和0.5 mol乙酸完全燃烧消耗的O2分子数都为0.2NA
C.标准状况下,1L辛烷充分燃烧后生成气态产物的分子数为 ![]() NA
NA
D.1 mol甲醇与足量钠反应,转移电子数目为2 NA
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,11.2L N2O4、NO2的混合气体中所含的氧原子数为NA
B. lmol Na 与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA
C. 向FeI2溶液中通入适量Cl2,当有lmolFe2+被氧化时,共转移的电子数目为NA
D. 高温下,0.2mol Fe与足量水蒸气反应,生成H2分子数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O
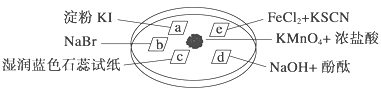
对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题 
(1)肼燃料电池原理如图所示,N2H4通入的一极应为电池的极(填“正”或“负”).
(2)火箭常用N2O4作氧化剂,肼作燃料,已知: N2(g)+2O2(g)═2NO2(g)△H=﹣67.7kJmol﹣1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=﹣534.0kJmol﹣1
2NO2(g)N2O4(g)△H=﹣52.7kJmol﹣1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式 .
(3)联氨的工业生产常用氨和次氯酸钠为原料获得,也可用尿素[CO(NH2)2]和次氯酸钠﹣氢氧化钠溶液反应获得,请写出尿素法反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰干电池所含的汞、酸或碱等在废弃后进入环境中将造成严重危害.对废旧电池进行资源化处理显得非常重要.某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源.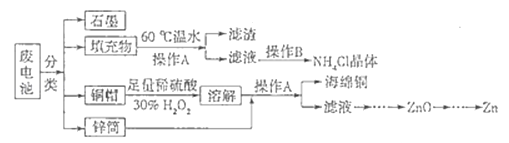
(1)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2 , 其负极的电极反应式为
(2)填充物用60℃温水溶解,目的是加快溶解速率,但必须控制温度不能太高,其原因是
(3)操作A的名称为
(4)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.其主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4═3MnSO4+4CO2↑+6H2O.
①当1mol MnO2参加反应时,共有 mol电子发生转移.
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出其反应的化学方程式:
(5)铜帽溶解时加入H2O2的目的是 (用化学方程式表示).铜帽溶解完全后,可采用 方法除去溶液中过量的H2O2 .
(6)锌锰干电池所含的汞可用KMnO4溶液吸收.在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如图所示:
根据图可知: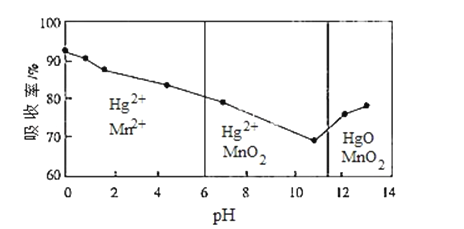
①pH对Hg吸收率的影响规律是
②在强酸性环境下Hg的吸收率高的原因可能是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.8kJ的热量(相当于25℃、101kPa下测得的热量). ①反应的热化学方程式为 .
②又已知H2O(l)═H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是kJ.
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 .
(2)已知热化学方程式:①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=﹣25kJmol﹣1②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=﹣47kJmol﹣1
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=19kJmol﹣1
写出FeO(s)被CO还原生成Fe和CO2的热化学方程式: .
(3)已知反应2HI(g)═H2(g)+I2(g)的△H=+11kJmol﹣1 , 1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为kJ.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)Z(g),经60s达到平衡,生成0.3mol Z,下列说法正确的是( )
A.若增大压强,则物质Y的转化率减小
B.将容器体积变为5 L,Z的平衡浓度变为原来的2倍
C.Y浓度变化表示的反应速率为0.0005 mol/(Ls )
D.若升高温度,X的体积分数增大,则该反应的△H>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com