
 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:解答题
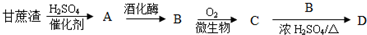
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 浓硝酸保存在带有玻璃塞的棕色试剂瓶中 | |
| B. | 已经完成定容的500mL 1.0mol•L-1的NaOH溶液,某同学不慎将容量瓶中溶液洒出部分,继续加水至溶液凹液面与刻线相切 | |
| C. | 用托盘天平称量出12.50g的NaCl固体 | |
| D. | 物质溶于水的过程中,一般有放热或吸热现象,因此溶解的操作不能在量筒中进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
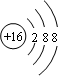 ,32g甲在足量浓硝酸中反应转移的电子数为2NA.
,32g甲在足量浓硝酸中反应转移的电子数为2NA.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.1g | B. | 3.6g | C. | 5.7g | D. | 37.7g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3→NO→NO2→HNO3 | B. | Al→Al2O3→Al(OH)3→NaAlO2 | ||
| C. | S→SO2→H2SO4→MgSO4 | D. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com