
| A. | 在相同温度下,等浓度的H2SO4和CH3COOH溶液中的c(H+) | |
| B. | 相同温度下,等浓度的Ba(OH)2和NaOH溶液,前者与后者的c(OH-) | |
| C. | 相同温度下,0.2 mol•L-1醋酸溶液和0.1 mol•L-1醋酸溶液中的c(H+) | |
| D. | 液面在“0”刻度时,50 mL碱式滴定管和25 mL碱式滴定管所盛液体的体积 |
分析 A.硫酸完全电离,而醋酸为弱电解质,部分电离;
B.等浓度的Ba(OH)2溶液中氢氧根离子浓度为氢氧化钡的2倍,NaOH溶液中氢氧根离子浓度与氢氧化钠的相等;
C.醋酸为弱电解质,浓度越大,电离程度越小;
D.滴定管最大刻度以下无刻度,体积不确定.
解答 解:A.硫酸完全电离,而醋酸为弱电解质,部分电离,在相同温度下,等浓度的H2SO4和CH3COOH溶液中c(H+)比值大于2:1,故A错误;
B.等浓度的Ba(OH)2溶液中氢氧根离子浓度为氢氧化钡的2倍,NaOH溶液中氢氧根离子浓度与氢氧化钠的相等,故B正确;
C.醋酸为弱电解质,浓度越大,电离程度越小,0.2mol•L-1CH3COOH溶液与0.1mol•L-1CH3COOH溶液中c(H+)比值小于2:1,故C错误;
D.滴定管最大刻度以下无刻度,体积不确定,则不能确定二者的体积关系,故D错误,
故选:B.
点评 本题考查电解质的电离、离子浓度比较、滴定管的使用,侧重于学生的分析能力的考查,注意相关基础知识的学习,难度不大.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 通过溴水除去甲烷中的乙炔 | |
| B. | 将乙醇加热到170℃制备乙烯 | |
| C. | 加入浓溴水后过滤除去苯中的苯酚 | |
| D. | 加入氢氧化钠后蒸馏除去乙酸乙酯中的乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
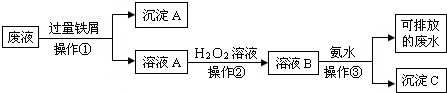
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
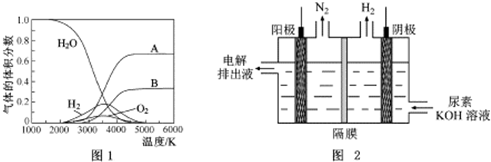
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度升高,三者都增大 | |
| B. | 室温下Ka(HCN)<Ka(CH3COOH),说明CH3COOH的电离度一定比HCN大 | |
| C. | 2SO2(g)+O2(g)?2SO3(g)平衡后,仅增大压强,平衡向右移动,但K值不变 | |
| D. | 化学平衡常数的大小与温度、浓度、催化剂等有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三氯生中含有氧气分子 | |
| B. | 三氯生由碳、氢、氯、氧四种元素组成 | |
| C. | 三氯生是一种有机物 | |
| D. | 一个三氯生分子共含有24个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com