
【题目】四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为TiO2、FeO、Fe2O3、Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤如下:

请回答下列问题:
(1)硫酸与二氧化钛反应的化学方程式是______________________________________。
(2)向滤液Ⅰ中加入铁粉,发生反应的离子方程式为____________、_______________。
(3)在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解。书写水解的离子方程式:_________。
(4)水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:_____________。
(5)过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、______(填化学式),减少废物排放。
(6)A可用于生产红色颜料(Fe2O3),其实验方法是:
a.5.56a kg A(摩尔质量为278g·mol-1)溶于水中,加入适量氢氧化钾溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;
b.再向红褐色胶体中加入33.36b kg A和1.12c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;
c.过滤后,沉淀经高温灼烧得红色颜料。
若所得滤液中溶质只有硫酸钾和硫酸铁,则理论上可生产红色颜料__________ kg。
【答案】TiO2+2H2SO4===Ti(SO4)2+2H2O或TiO2+H2SO4===TiOSO4+H2O 2Fe3++Fe===3Fe2+Fe+2H+===H2↑+Fe2+Ti++ 4H2O![]() TiO2·H2O+4H+加水促进钛盐水解,加热促进钛盐水解,降低H+浓度促进钛盐水解H2O、FeSO4、H2SO41.60a+3.20b+1.60c
TiO2·H2O+4H+加水促进钛盐水解,加热促进钛盐水解,降低H+浓度促进钛盐水解H2O、FeSO4、H2SO41.60a+3.20b+1.60c
【解析】
(1)化学方程式为:TiO2+2H2SO4=Ti (SO4)2+2H2O或TiO2+H2SO4=TiOSO4+H2O;
(2)浓硫酸有强氧化性,加入钛铁矿渣中能生成Fe3+,加入铁粉,发生Fe+2Fe3+=3Fe2+;铁粉还可以与溶液中过量的H+反应,离子方程式为:Fe+2H+=Fe2++H2↑;
(3) 钛盐水解的离子方程式:Ti++ 4H2O![]() TiO2
TiO2![]() H2O+4H+;
H2O+4H+;
(4)影响钛盐水解的因素有浓度、温度等,高温水蒸气使水解平衡移动的作用是:加水、加热、降低H+浓度均可促进钛盐水解;
(5)根据该工艺流程知:滤液Ⅲ的主要成分为大量的钛盐、溶解的硫酸亚铁、少量的硫酸(混合液pH达0.5)等,钛盐水解后过滤去水合二氧化钛,得到的滤液中含有未水解的钛盐及FeSO4、H2SO4、H2O等;
(6)依题意A与适量氢氧化钠溶液恰好完全反应,FeSO4+2NaOH=Na2SO4+Fe(OH)2↓,根据开始加入A为2a×103mol,可知加入氢氧化钠为4a×103mol;后来又加入12b×103mol的A和
20cmol的铁,由Na2SO4、FeSO4、Fe2(SO4)3、Fe2O3等化学式的定量组成和守恒思想分别可求得以下各量:利用Na+离子守恒,n(NaOH)=2n(Na2SO4),可知Na2SO4物质的量为20amol;利用SO42-离子守恒,n(FeSO4)=n(Na2SO4)+3n[Fe2(SO4)3],可知Fe2(SO4)3物质的量为(20a+120b-20a)mol×![]() =40bmol;利用Fe元素守恒,n(FeSO4)+n(Fe)=2n[Fe2(SO4)3]+2n(Fe2O3),可知n(Fe2O3)=(20a+120b+20c-40b×2)mol×
=40bmol;利用Fe元素守恒,n(FeSO4)+n(Fe)=2n[Fe2(SO4)3]+2n(Fe2O3),可知n(Fe2O3)=(20a+120b+20c-40b×2)mol×![]() =(10a+20b+10c)mol,计算得m(Fe2O3)=(1.60a+3.20b+1.60c) kg
=(10a+20b+10c)mol,计算得m(Fe2O3)=(1.60a+3.20b+1.60c) kg


科目:高中化学 来源: 题型:
【题目】常温下有H2RO4=H++HRO4-、HRO4-![]() H++RO42-,现有物质的量浓度都为0.1mol/L的三种溶液:①NaHRO4溶液; ②H2RO4溶液; ③Na2RO4溶液。下列说法正确的是
H++RO42-,现有物质的量浓度都为0.1mol/L的三种溶液:①NaHRO4溶液; ②H2RO4溶液; ③Na2RO4溶液。下列说法正确的是
A. ②和③等体积混合后的溶液中: c( Na+)= c( HRO4-)+c(H2RO4) +c(RO42-)
B. 100mL①溶液中: n(HRO4-)+n(RO42-)+n(OH-)-n(H+)= 0.01
C. ①和②等体积混合后的溶液中可能的离子浓度为c( HRO4-)>c(H+)>c(Na+)
D. 若①和③等体积混合后,会抑制水的电离,则HRO4-的电离程度肯定大于RO42-的水解程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略)如下:

有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10 mL环己醇的A中,在55 ~ 60℃进行反应。反应完成后,加入适量水,蒸馏,收集95 ~ 100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的名称为____________________________。
(2)酸性Na2Cr2O7溶液氧化环己醇反应的![]() ,反应剧烈将导致体系温度迅速上升,副反应增多。
,反应剧烈将导致体系温度迅速上升,副反应增多。
①滴加酸性Na2Cr2O7溶液的操作为____________________________________________;
②蒸馏不能分离环己酮和水的原因是__________________________________________。
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加人无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是________________________________________________;
②B中水层用乙醚萃取的目的是______________________________________________;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有__________,操作d中,加入NaC1固体的作用是_____________________________。
(4)恢复至室温时,分离得到纯产品体积为6 mL,则环已酮的产率为____________。(计算结果精确到0.1%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料,某研究性学习小组查阅资料得知,漂白粉与硫酸反应可制取氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O。他们利用该反应设计如图所示装置制取氯气并验证其性质的实验。(B中装淀粉KI溶液,C中装Na2SO3溶液,D中装FeCl2溶液)
2CaSO4+2Cl2↑+2H2O。他们利用该反应设计如图所示装置制取氯气并验证其性质的实验。(B中装淀粉KI溶液,C中装Na2SO3溶液,D中装FeCl2溶液)

回答下列问题:
(1)该实验中A部分的装置是______(填标号)。

(2)装置B中产生的现象为______。
(3)请设计实验验证装置C中的Na2SO3已被氧化______。
(4)写出D装置中发生反应的离子方程式______。
(5)该实验存在明显的缺陷,请你提出改进的方法______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应过程中,同时有离子键、极性共价键和非极性共价键断裂和形成的反应是
A. NH4Cl![]() NH3↑+HCl↑ B. 2Na2O2+2CO2===2Na2CO3+O2
NH3↑+HCl↑ B. 2Na2O2+2CO2===2Na2CO3+O2
C. 2NaOH+Cl2===NaCl+NaClO+H2O D. CaC2+H2O===Ca(OH)2+C2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物,如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如下:
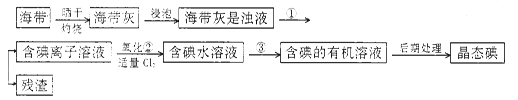
(1)指出提取碘的过程中有关的实验操作名称:①____________________;③______________。
若实验②中采用酸性条件下加入双氧水,则有关反应的离子方程式_________________________________。
(2)提取碘的过程中,可供选择的有关试剂是___________。
A.甲苯,酒精B.四氯化碳,苯C.汽油,乙酸D.汽油,甘油
(3)含碘的有机溶液后期处理得到晶态碘需要进行的操作为___________;
最后,晶态碘在___________里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸苯乙酯![]() 是一种天然抗癌药物。在一定条件下能发生如下转化。
是一种天然抗癌药物。在一定条件下能发生如下转化。
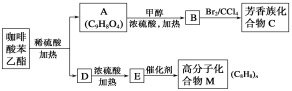
请回答下列问题:
(1)A分子中的官能团是_______________________________。
(2)高分子化合物M的结构简式是_______________________________。
(3)写出A→B反应的化学方程式:_________________________。A→B的反应类型为__________。
(4)E→M的反应方程式为_____________________;B→C的反应类型为__________。
(5)A的同分异构体有很多种,其中同时符合下列条件的同分异构体有________种。
①苯环上只有两个取代基 ②能发生银镜反应③能与碳酸氢钠溶液反应 ④能与氯化铁溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核磁共振氢谱是研究有机物结构的有力手段之一,例如乙醛的结构简式为CH3-CHO,在核磁共振氢谱中有两个峰,其峰面积之比为3:1。
(1)结构式为![]() 的有机物,在核磁共振氢谱上吸收峰的面积之比为 __________;
的有机物,在核磁共振氢谱上吸收峰的面积之比为 __________;
(2)某含氧有机物,其质谱图中最大质荷比为46.0,碳的质量分数为52.2%,氢的质量分数为13.0%,核磁共振氢谱中只有一个吸收峰,则该有机物的相对分子质量为___________,其结构简式是 _________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素a、b、c、d的原子序数依次增大,a和b的价电子数之和等于c和d的最外层电子数之和,这四种元素组成两种盐b2da3和bca2。在含该两种盐的混合溶液中滴加盐酸,产生白色沉淀的物质的量与盐酸体积的关系如图所示。下列说法正确的是( )

A. 原子半径:b>c>a>d B. 气态氢化物热稳定性:a>d
C. d的氧化物常用于太阳能电池 D. 工业上电解c的氯化物冶炼单质c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com