
对于H2SƒH++HS-、HS-ƒH++S2-电离平衡中,由于下列条件改变(温度不变),下列浓度变化用升降箭头表示在下表中:
S2-的浓度 H+的浓度
加少量水
加CuSO4(s)
加NaOH(s)
通HCl(g)
科目:高中化学 来源: 题型:阅读理解
| 反应过程 | 化学方程式 | △H(kJ?mol-1) |
| 甲醇合成反应 | 2H2(g)+CO(g)=CH3OH(g) | -90.8 |
| 水煤气变换反应 | CO(g)+H2O(g)═CO2(g)+H2(g) | -41.3 |
| 甲醇脱水反应 | 2CH3OH(g)=CH3OCH3(g)+H2O(g) | -23.5 |
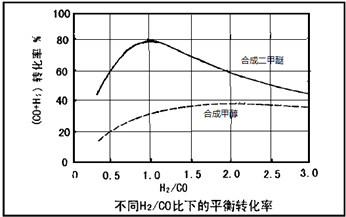
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
S2-的浓度 H+的浓度
加少量水
加CuSO4(s)
加NaOH(s)
通HCl(g)
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:038
在一定温度下,对于难溶电解质AmBn,在水中可建立如下平衡:
AmBnƒmAn++nBm-
在一定温度下,当c(An+)m×c(Bm-)n=Ksp时,溶液呈饱和状态,沉淀量既不增加,也不减少;当c(An+)m×c(Bm-)n>Ksp时,溶液呈过饱和状态,将析出沉淀;当c(An+)m×c(Bm-)<Ksp时,溶液呈不饱和状态,沉淀将溶解。
试根据上述原理,计算:
(1)已知在常温下,FeS的Ksp=6.25´10-18,求此温度下FeS的溶解度(g/100g水)。(设饱和溶液的密度为1g×mL-1)
(2)已知H2S饱和溶液在常温下,c(H+)与c(S2-)间存在着以下关系:c(H+)2×c(S2-)=1.0´10-22。在该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中c(Fe2+)到达1mol×L-1,应调节溶液的pH为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:038
1998年南方发生洪涝灾害,群众饮水也成了大问题,因为洪水有多种病菌。为此有关部门调集大量漂白粉用于水的处理,在消毒时,加一点儿醋,消毒快效果好,这是为什么?
在一定温度下,对于难溶电解质AmBn,在水中可建立如下平衡:
AmBnƒmAn++nBm-
在一定温度下,当c(An+)m×c(Bm-)n=Ksp时,溶液呈饱和状态,沉淀量既不增加,也不减少;当c(An+)m×c(Bm-)n>Ksp时,溶液呈过饱和状态,将析出沉淀;当c(An+)m×c(Bm-)<Ksp时,溶液呈不饱和状态,沉淀将溶解。
试根据上述原理,计算:
(1)已知在常温下,FeS的Ksp=6.25´10-18,求此温度下FeS的溶解度(g/100g水)。(设饱和溶液的密度为1g×mL-1)
(2)已知H2S饱和溶液在常温下,c(H+)与c(S2-)间存在着以下关系:c(H+)2×c(S2-)=1.0´10-22。在该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中c(Fe2+)到达1mol×L-1,应调节溶液的pH为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com