
| A. | 直线形;三角锥形 | B. | V形;三角锥形 | ||
| C. | 直线形;平面三角形 | D. | V形;平面三角形 |
分析 价层电子对互斥理论认为:分子的立体构型是“价层电子对”相互排斥的结果.价层电子对就是指分子中的中心原子上的电子对,包括σ 键电子对和中心原子上的孤电子对;σ 键电子对数和中心原子上的孤电子对数之和就是价层电子对数,孤电子对数=$\frac{1}{2}$(a-xb),a为中心原子的价电子数,x为与中心原子结合的原子数,b为与中心原子结合的原子最多能接受的电子数,由于价层电子对的相互排斥,就可得到含有孤电子对的VSEPR模型,略去孤电子对就是该分子的空间构型.
解答 解:H2S分子的中心原子S原子上含有2个σ 键,中心原子上的孤电子对数=$\frac{1}{2}$(a-xb)=$\frac{1}{2}$(6-2×1)=2,所以硫化氢分子的VSEPR模型是四面体型,略去孤电子对后,实际上其空间构型是V型;
NF3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电子对数=$\frac{1}{2}$(a-xb)=$\frac{1}{2}$(5-3×1)=1,所以NF3分子的VSEPR模型是四面体型,略去孤电子对后,其空间构型是三角锥形.
故选B.
点评 本题考查了分子空间构型的判断,题目难度中等,易错点是阴阳离子中孤电子对数的确定,注意中心原子上的孤电子对数=$\frac{1}{2}$(a-xb),a为中心原子的价电子数,x为与中心原子结合的原子数,b为与中心原子结合的原子最多能接受的电子数.


科目:高中化学 来源: 题型:选择题
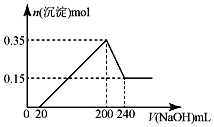 将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.若不考虑金属和盐酸反应时HCl的挥发.则下列说法正确的是( )
将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.若不考虑金属和盐酸反应时HCl的挥发.则下列说法正确的是( )| A. | NaOH溶液的物质的量浓度为2.5mol•L-1 | |
| B. | 盐酸的物质的量浓度为5mol•L-1 | |
| C. | 镁和铝的总质量为9g | |
| D. | 生成的氢气在标准状况下的体积为11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性HX<HY | |
| B. | 结合H+的能力Y->CO32->X->HCO3- | |
| C. | 溶液的碱性NaX>Na2CO3>NaY>NaHCO3 | |
| D. | HX和HY酸性相同,但比H2CO3弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小:W>Z>Y | |
| B. | 简单气态氢化物的热稳定性:W>X | |
| C. | Y、Z、W最高价氧化物对应水化物能够两两发生反应 | |
| D. | 简单离子的还原性:X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
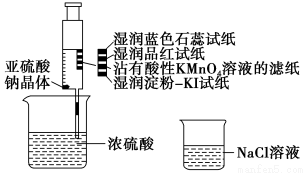
| A. | 蓝色石蕊试纸先变红后褪色 | |
| B. | 品红试纸、蘸有酸性KMnO4溶液的滤纸均褪色,证明SO2具有漂白性 | |
| C. | 湿润淀粉-KI试纸未变蓝说明SO2的氧化性弱于I2 | |
| D. | NaCl溶液可用于除去实验中多余的SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
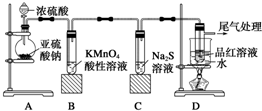
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com