
【题目】FeCl3溶液中的水解反应:FeCl3+3H2O![]() Fe(OH)3+3HCl已达平衡,若要使FeCl3的水解程度增大,应采用的方法是
Fe(OH)3+3HCl已达平衡,若要使FeCl3的水解程度增大,应采用的方法是
A. 加入NaCl B. 加入AgNO3固体 C. 加入FeCl3固体 D. 加热
 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:
【题目】在反应2Al+6HCl=2AlCl3+3H2中:
(1)该反应被氧化的元素是______,被还原的元素是_______(填元素符号)。
(2)该反应中氧化剂是________,还原剂是________(填元素符号)。
(3)若反应中转移电子3mol,则在反应中消耗Al________mol。
(4)用双线桥法表示下列反应的电子转移情况:________。
Zn + 2HCl = ZnCl2+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[3,3]庚烷(![]() )是其中的一种。下列关于该化合物的说法正确的是
)是其中的一种。下列关于该化合物的说法正确的是
A. 与甲苯(C7H8)互为同分异构体
B. 1mol该化合物完全燃烧时消耗10 mol O2
C. 所有碳原子均处同一平面
D. 一氯代物共有3种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下方法来合成甲醇:
(1)用CO2生产甲醇。
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l) △H=﹣akJmol﹣1;
2H2(g)+O2(g)═2H2O(l) △H=﹣b kJmol﹣1;
则表示CH3OH(g)燃烧的热化学方程式为:____________________。
(2)用CO生产甲醇。
已知:CO(g)+2H2(g) ![]() CH3OH(g),下图是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),下图是该反应在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变ΔH__________0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______K2 (填 “>”、“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是______________。
A.升高温度 B. 将CH3OH(g)从体系中分离
C.使用合适的催化剂 D. 充入He,使体系总压强增大
(3)甲醇(CH3OH)可以用作燃料电池,该电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。负极发生的电极反应式是________________________,正极发生的电极反应式是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.化学电源在生产生活中有着广泛的应用,电动汽车上用的铅蓄电池是以一组充满海绵状态铜的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。放电时总反应为:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
(1)写出放电时负极的电极反应式:______________________________;
(2)铅蓄电池放电时,溶液的pH将_________(填“增大”、“减小”或“不变”)。当外电路上有0.5mol电子通过时,溶液中消耗H2SO4的物质的量为___________。
(3)放电完后,对该电池进行充电,在连接电源的负极一端生成________。(填“Pb”或“PbO2”)
Ⅱ.光气(COCl2)是一种重要化工原料,常用于聚酯类材料的生产,工业上通过Cl2(g)+CO(g)![]() COCl2(g) △H < 0制备。下图为实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g) △H < 0制备。下图为实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:

(4)0~6min内,反应的平均速率v(Cl2)=________________;
(5)该反应第一次达平衡时的平衡常数为_________________,10min改变的条件是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有机物的结构、性质有关的叙述不正确的是
A. 乙醇、乙烯均能使酸性KMnO4溶液褪色
B. 光照下甲烷和Cl2的反应、在FeBr3催化下苯和Br2的反应属于同一类型的反应
C. 甲醇、醋酸均能与Na反应放出H2,但二者所含官能团不相同
D. 甲苯的一氯代物的同分异构体有三种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定是几百年来科学家一直研究的课题。请回答下列问题:
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
反应 | 大气固氮 N2 (g)+O2 (g) | 工业固氮 N2 (g)+3H2 (g) | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于 ________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因是 ________。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因 ________。
(2)已知工业固氮反应:N2(g)+ 3H2(g)![]() 2NH3(g)ΔH =-94.4kJ·mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图1所示,各时间段最终均达平衡状态。
2NH3(g)ΔH =-94.4kJ·mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图1所示,各时间段最终均达平衡状态。
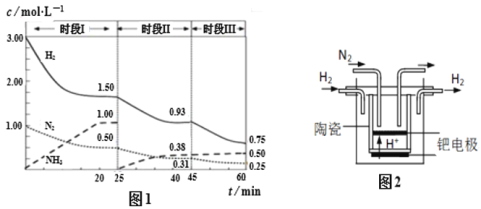
①在2L容器中发生反应,前20min内,ν(NH3) = ________。
②25 min时采取的某种措施是 ________。
③时段III条件下反应的平衡常数为 ________ L2· mol-2(保留3位有效数字) 。
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电解法合成氨,提高了反应物的转化率,其实验简图如图2所示,阴极的电极反应式是 ________。
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g),则其反应热ΔH = ________。已知:N2(g)+ 3H2(g)
4NH3(g)+3O2(g),则其反应热ΔH = ________。已知:N2(g)+ 3H2(g)![]() 2NH3(g) ΔH1 =-92.4kJ·mol-1 2H2(g) +O2(g)
2NH3(g) ΔH1 =-92.4kJ·mol-1 2H2(g) +O2(g)![]() 2H2O(l) ΔH2 =-571.6kJ·mol-1
2H2O(l) ΔH2 =-571.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能说明钠比铝活泼的是
A.最外层电子数钠原子比铝原子少
B.相等物质的量的钠和铝分别和盐酸反应,钠产生的气体少
C.钠与铝的电子层数相等
D.常温下钠能与水剧烈反应,而铝不能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 糖类、油脂和蛋白质都是天然高分子化合物
B. 煤的干馏和石油的分馏都是化学变化
C. 催化裂化的目的是提高汽油、煤油和柴油等轻质油的产量
D. 由煤的干馏可知煤中含苯、二甲苯等芳香族化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com