
【题目】关于化学反应,下列叙述中不正确的是 ( )
①放热的反应发生时不必加热 ②化学反应一定有能量变化 ③吸热反应需要加热后才能发生 ④化学反应热效应数值与参加反应的物质的量多少有关。
A. ②④B. ②③C. ①③D. ①②
【答案】C
【解析】
①一个化学反应发生的条件与反应的热效应无关;
②由于反应物、生成物具有的能量不同,化学反应中一定有能量变化;
③有的吸热反应不需要任何条件即可发生;
④参加反应的物质越多,反应热的数值就越大。
①放热的反应在常温下不一定很容易发生。如:铝热反应2Al+Fe2O3![]() Al2O3+2Fe是放热反应,但需在高热条件下以保证足够的热量引发氧化铁和铝粉反应,①错误;
Al2O3+2Fe是放热反应,但需在高热条件下以保证足够的热量引发氧化铁和铝粉反应,①错误;
②由于反应物、生成物具有的能量不同,化学反应中一定有能量变化,其表现形式有热量、光能和电能等,如木材燃烧,放出热量的同时发光,②正确;
③有的吸热反应不需要任何条件即可发生,如氯化铵和氢氧化钡晶体的反应,③错误;
④不论是吸热反应还是放热反应,反应热效应的数值均与参加反应的物质的多少有关。参加反应的物质越多,反应热的数值就越大,反之,越小,④正确;
故含量选项是C。


科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验。
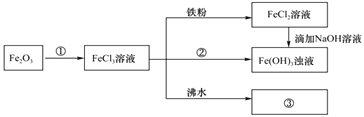
(1)请写出Fe2O3与①反应的离子方程式___。
(2)物质②可能为___。
(3)请写出FeCl3与铁粉反应的离子方程式___。
(4)向FeCl2溶液中滴加NaOH溶液,该过程的现象为___,过程中发生的氧化还原反应为(用化学方程式表达)___。
(5)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得分散系③___,提纯此分散系的方法叫___,它与FeCl3溶液、Fe(OH)3浊液的本质区别是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉)。请回答:

(1)仪器A的名称是________,烧瓶中反应的化学方程式是_____________________。
(2)装置B中盛放液体是___,气体通过装置B的目的是__________________,装置C中盛放的液体是_________。
(3)D中反应的化学方程式是__________________________________________。
(4)烧杯E中盛放的液体是_____,反应的离子方程式是___________。
(5)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应.为收集D中产物,在D与E之间,除增加收集装置外,还需要增加__装置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组以苯和乙烯为主要原料,合成药物普鲁卡因:
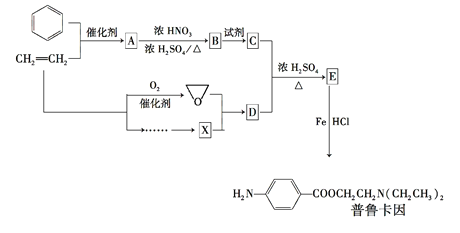
已知: ![]()
![]()
![]() ,RX+
,RX+![]()
![]() +HX,
+HX,![]() +
+![]()
![]()
请回答下列问题:
(1)对于普鲁卡因,下列说法正确的是__。
A.可与浓盐酸形成盐 B.不与氢气发生加成反应
C.可发生水解反应 D.能形成内盐
(2)写出化合物B的结构简式____。
(3)写出B→C反应所需的试剂_____。
(4)写出同时符合下列条件的B的所有同分异构体的结构简式_______。①分子中含有羧基②1H—NMR谱显示分子中含有苯环,且苯环上有两种不同化学环境的氢原子
(5)通常采用乙烯为原料制得环氧乙烷后与X反应合成D,请用化学反应方程式表示以乙烯为原料制备X的合成路线(无机试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃先将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.lmol/L的KOH溶液以测定氯水的浓度。此过程中溶液pH变化的曲线如图所示。
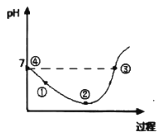
下列叙述中正确的是( )
A.滴定过程中,当水电离的c(H+)=10-7mol/L时,溶液显中性
B.滴定过程中宜选用酚酞为指示剂,不宜选用甲基橙为指示剂
C.②点的溶液中c(H+)>c(Cl-)>c(HClO)>c(ClO-)
D.③点溶液中c(K+)+c(H+)=c(OH-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀废水中常含有阴离子A,排放前可加CuSO4溶液处理,使之转化为沉淀B,按如下流程进行实验。
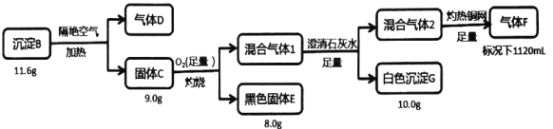
已知:B含三种元素;气体D标况下密度2.32g/L;混合气体l无色无味;气体F标况下密度为1.25g/L。请回答:
(1)组成B的三种元素是___,气体D的分子式是___。
(2)写出固体C在足量氧气中灼烧的方程式___。
(3)固体C在沸腾的稀盐酸中会生成一种弱酸和一种白色沉淀,该白色沉淀是共价化合物(测其分子量为199),则反应的化学方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经检测某工厂的酸性废水中所含离子及其浓度如下表所示:
离子 | Fe3+ | Cu2+ | SO42- | Na+ | H+ |
浓度/(mol/L) | 2×10-3 | 1×10-3 | 1×10-2 | 2×10-3 |
(1)c(H+)=________mol/L。
(2)为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(FeSO4·7H2O).

① 工业废水中加入铁粉后,反应的离子方程式为:Fe+Cu2+ =Fe2++Cu、________________、_________________。
②试剂B是__________。
③ 操作③是_____________、_____________、过滤,最后用少量冷水洗涤晶体,在低温下干燥。
④通过检验溶液D中Fe3+来判断废水中Fe3+是否除尽,实验方法是__________________。
⑤ 获得的FeSO4·7H2O需密闭保存,原因是___________________________。若将所得FeSO4·7H2O配成溶液,向溶液中滴加NaOH溶液的现象是_________________________________________________________________。
⑥上述1000 L废水经处理,可获得 FeSO4·7H2O的物质的量是_________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com