
(14分)HNO3是极其重要的化工原料。工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的。(1)工业上用水吸收二氧化氮生产硝酸,生成的气体经过多次氧化、吸收的循环操作使其充分转化为硝酸(假定上述过程中无其它损失)。
① 试写出上述反应的化学方程式。
② 设循环操作的次数为n,试写出NO2→HNO3转化率与循环操作的次数n之间关系的数学表达式。
③ 计算一定量的二氧化氮气体要经过多少次循环操作,才能使95%的二氧化氮转变为硝酸?
(2) 上述方法制备的HNO3为稀硝酸,将它用水稀释或蒸馏、浓缩可制得不同浓度的HNO3。实验证明:不同浓度的HNO3与同一金属反应可生成不同的还原产物。例如,镁与硝酸反应实验中,测得其气相产物有H2、N2、NO、NO2,液相产物有Mg(NO3)2,NH4NO3和H2O。生成这些产物的HNO3浓度范围为:H2:c<6.6 mol/L;N2和NH4+:c<10 mol/L;NO:0.1 mol/L<c<10 mol/L;NO2:c>0.1 mol/L。各气相产物成分及含量随HNO3浓度变化曲线如下图所示。
④ 写出Mg与11 mol/L的HNO3反应的方程式;
⑤ 960 mg Mg与一定体积4 mol/L的HNO3恰好完全反应,收集到224 mL气体(S.T.P)气体,试通过计算写出反应方程式。
(1) (8分)
① (2分)3NO2+H2O![]() 2HNO3+NO;2NO+O2=2NO2
2HNO3+NO;2NO+O2=2NO2
② (3分)设起始时NO2物质的量为1 mol,经过n次循环后生成HNO3的物质的量为:
Sn=2/3+2/3′1/3+2/3′(1/3)2+2/3′(1/3)3+??????+2/3′(1/3)n-1,经等比数列求和得Sn=1-(1/3)n。因此,NO2→HNO3转化率为[1-(1/3)n]/1′100%
③ (3分)[1-(1/3)n]/1′100%=95%,因此,n=2.6≈3,要经过3次循环操作才能使95%的NO2转化为HNO3
(2) (7分)
④ (2分)Mg+4HNO3![]() Mg(NO3)2+2NO2↑+2H2O
Mg(NO3)2+2NO2↑+2H2O
⑤ (5分)由图象可知:n(NO):n(N2):n(NO2):n(H2)=5:3:1:1,同时还原产物还有NH4+,并通过得失电子相等确定与前者的关系。
40Mg+100HNO3![]() 5NO↑+H2↑+NO2↑+3N2↑+4NH4NO3+40Mg(NO3)2+41H2O
5NO↑+H2↑+NO2↑+3N2↑+4NH4NO3+40Mg(NO3)2+41H2O


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
(14分)Cu2S是火法炼铜一种重要的原料,下面是由Cu2S冶炼铜及制取CuSO4·5H2O的流程图:
⑴Cu2S中铜元素的化合价为 ,火法炼铜的反应原理是 (用化学方程式表示)。
⑵Cu2O,CuO加入足量稀硫酸得到的体系A中看到溶液呈蓝色,且有红色物质生成,
请写出生成红色物质的离子方程式: 。
⑶若将A中单质反应,操作加入试剂最好是 。
A. 加入适量的NaNO3 B. 适量的 HNO3 C. 适量的H2O2
⑷若B溶液的体积为0.2L,电解B溶液一段时间后溶液的pH值由2变为1(体积变化忽略不计),此时电解过程中转移电子数的物质的量是 。
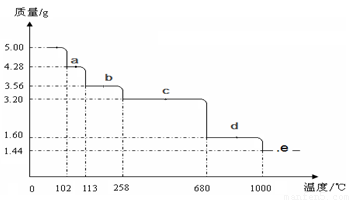
⑸取5.0 g胆矾样品逐渐升高温度使其分解,分解过程的热重曲线如下图所示:通过计算确定258℃时发生反应的化学方程式 ,e点的化学式 (计算过程略去)。
查看答案和解析>>
科目:高中化学 来源:2012届吉林省长春市高三第一次调研测试化学试卷 题型:填空题
(14分)Cu2S是火法炼铜一种重要的原料,下面是由Cu2S冶炼铜及制取CuSO4·5H2O的流程图:
⑴Cu2S中铜元素的化合价为 ,火法炼铜的反应原理是 (用化学方程式表示)。
⑵Cu2O,CuO加入足量稀硫酸得到的体系A中看到溶液呈蓝色,且有红色物质生成,
请写出生成红色物质的离子方程式: 。
⑶若将A中单质反应,操作加入试剂最好是 。
A. 加入适量的NaNO3 B. 适量的 HNO3 C. 适量的H2O2
⑷若B溶液的体积为0.2L,电解B溶液一段时间后溶液的pH值由2变为1(体积变化忽略不计),此时电解过程中转移电子数的物质的量是 。
⑸取5.0 g胆矾样品逐渐升高温度使其分解,分解过程的热重曲线如下图所示:通过计算确定258℃时发生反应的化学方程式 ,e点的化学式 (计算过程略去)。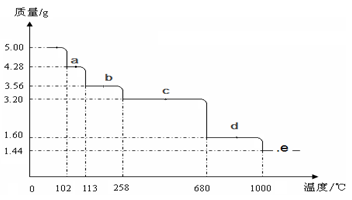
查看答案和解析>>
科目:高中化学 来源:2012-2013学年宁夏高三第一次月考理综化学试卷(解析版) 题型:填空题
(14分) HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的
Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填序号)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D. 用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:___________________________________。
(4) Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为
Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为2∶1,试配平下列方程式:
FeSO4+K2O2―→K2FeO4+K2O+K2SO4+O2↑
(6)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。高铁酸钾作为水处理剂发挥的作用是________________________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年吉林省长春市高三第一次调研测试化学试卷 题型:填空题
(14分)Cu2S是火法炼铜一种重要的原料,下面是由Cu2S冶炼铜及制取CuSO4·5H2O的流程图:
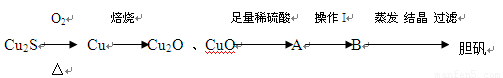
⑴Cu2S中铜元素的化合价为 ,火法炼铜的反应原理是 (用化学方程式表示)。
⑵Cu2O,CuO加入足量稀硫酸得到的体系A中看到溶液呈蓝色,且有红色物质生成,
请写出生成红色物质的离子方程式: 。
⑶若将A中单质反应,操作加入试剂最好是 。
A. 加入适量的NaNO3 B. 适量的 HNO3 C. 适量的H2O2
⑷若B溶液的体积为0.2L,电解B溶液一段时间后溶液的pH值由2变为1(体积变化忽略不计),此时电解过程中转移电子数的物质的量是 。
⑸取5.0 g胆矾样品逐渐升高温度使其分解,分解过程的热重曲线如下图所示:通过计算确定258℃时发生反应的化学方程式 ,e点的化学式 (计算过程略去)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com