

| 选项 | 实验现象 | 解释 |
| A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
| B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
| C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
| D | 品红溶液褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
分析 向Na2SO3固体上滴几滴浓硫酸反应生成二氧化硫气体,二氧化硫不与氯化钡反应,SO2与Na2S溶液反应产生了S单质,二氧化硫具有还原性含有高锰酸钾溶液褪色,二氧化硫气体使品红溶液褪色;据此分析.
解答 解:向Na2SO3固体上滴几滴浓硫酸反应生成二氧化硫气体,依据二氧化硫的性质判断;
A、二氧化硫不与氯化钡反应,不能生成BaSO3沉淀;故A错误;
B、SO2与Na2S溶液反应,发生氧化还原反应产生了S单质;故B正确;
C、二氧化硫具有还原性能使高锰酸钾溶液褪色,表现二氧化硫的还原性;故C正确;
D、向Na2SO3固体上滴几滴浓硫酸反应生成二氧化硫气体,二氧化硫气体使品红溶液褪色,证明二氧化硫的漂白性,故D正确;
故选A.
点评 本题考查了二氧化硫的性质分析判断,注意反应现象的分析和性质的应用是解题关键,题目难度不大,侧重于考查学生对基础知识的综合应用能力.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 粉末中一定有Na2O、Na2O2、NaHCO3 | |
| B. | 粉末中一定不含有Na2CO3和NaCl | |
| C. | 粉末中一定含有Na2O和NaHCO3 | |
| D. | 无法肯定粉末里是否含有NaHCO3和NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验自来水中含有Cl- | B. | 检验鸡蛋壳中含有碳酸盐 | ||
| C. | 检验加碘食盐中加的不是碘单质 | D. | 除去热水瓶中的水垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Ca2+)、c(OH-)均增 | B. | c(Ca2+)、c(OH-)均保持不变 | ||
| C. | c(Ca2+)、c(OH-)均减小 | D. | 溶液质量增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属单质的密度都比水小 | |
| B. | 碱金属单质都是还原剂 | |
| C. | 碱金属单质的熔沸点一般随着原子的电子层数的增多而升高 | |
| D. | 碱金属单质在氧气中燃烧,产物都是过氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
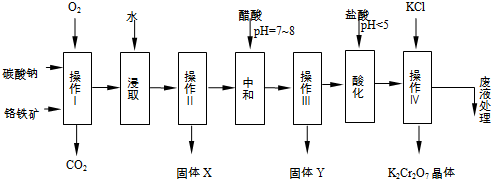
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com