��������̼���á������ʹ�����CO
2�ĺ����������ڽ�������ů�Ļ������⣮
��1����ҵ�Ͽ���CO
2������ȼ�ϼ״�����Ӧԭ��Ϊ��CO
2��g��+3H
2��g���TCH
3OH��g��+H
2O��g����H��0��һ���¶��£������Ϊ2L�ĺ����ܱ������У�����2molCO
2��6molH
2��һ�������·�����Ӧ�����CO
2��CH
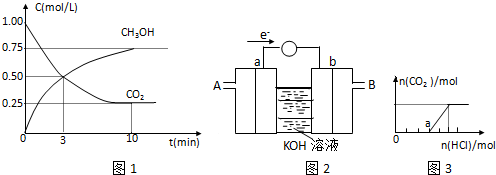
3OH��Ũ����ʱ��仯��ͼ1��ʾ��
�ٴﵽƽ��ʱ��CO
2��ת����=
�ڴӷ�Ӧ��ʼ��ƽ�⣮������ƽ����Ӧ����V��H
2��=
mol/��L?min����
�������ڵ�ƽ��ѹǿ����ʼѹǿ֮��Ϊ
�ܱ��������ݻ����䣬���д�ʩ����ʹƽ����ϵ�У�
�������
A�������¶�
B������He��g����ʹ��ϵѹǿ����
C����H
2O��g������ϵ�з������
D���ٳ���1molCO
2��3molH
2��ijͬѧ���ݼ״�ȼ�յķ�Ӧԭ���������ͼ2��ʾ�ĵ��װ�ã�a��b��Ϊ���Ե缫��ʹ��ʱ��������
��ͨ�루�A����B������a���ĵ缫��ӦʽΪ
��2����һ������CO
2����ͨ��NaOH��Һ�У�����������Һ����μ������ᣬ�ӱ�����������������������HCl���ʵ�����ϵ��ͼ3��ʾ������������ܽ��HCl�Ļӷ�������ش�O����Һ�����ʵĻ�ѧʽ
��a����Һ�и�����Ũ���ɴ�С��˳����
��