
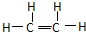 ,分子中碳原子与碳原子通过两对共用电子对相连接,碳原子与氢原子通过一对共用电子对相连接,所以电子式为
,分子中碳原子与碳原子通过两对共用电子对相连接,碳原子与氢原子通过一对共用电子对相连接,所以电子式为 ,
, ;
; ,
, ;
; 

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
| 化合物/选项 | A | B | C | D |
| Y | CO2 | FeCl2 | H2O | SO3 |
| W | MgO | ZnCl2 | NaOH | SO2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第三周期第ⅢA族 |
| B、第二周期第ⅢA族 |
| C、第三周期第ⅡA族 |
| D、第四周期第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
| A、③ | B、③④ | C、④ | D、①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2F2+2H2O═4HF+O2 | ||||
| B、2Na+2H2O═2NaOH+H2↑ | ||||
| C、CaO+H2O═Ca(OH)2 | ||||
D、2H2O
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com