
A、B、C均为短周期的元素,A、B同周期,A、C的最低价离子分别为A2﹣和C﹣,B2+和C﹣具有相同的电子层结构,下列说法正确的是()
A. C元素的最高正价为+7价 B. 原子半径:A>B>C
C. 离子半径:A2﹣>C﹣>B2+ D. 还原性:A2﹣<C﹣
考点: 原子结构与元素周期律的关系.
专题: 元素周期律与元素周期表专题.
分析: 由A、C的最低价离子分别为A2﹣和C﹣,则A为ⅥA族元素,C为ⅦA族元素,B2+和C﹣具有相同的电子层结构,则B在C的下一周期,则B为Mg元素,C为F元素,A、B同周期,则A为S元素,
A、C为F元素,无正价;
B、同周期原子半径从左到右逐渐减小,电子层数越多,半径越大;
C、具有相同核外电子结构的离子,核电荷数越大,半径越小;
D、元素的非金属性越强,对应阴离子的还原性越弱.
解答: 解:由A、C的最低价离子分别为A2﹣和C﹣,则A为ⅥA族元素,C为ⅦA族元素,B2+和C﹣具有相同的电子层结构,则B在C的下一周期,则B为Mg元素,C为F元素,A、B同周期,则A为S元素,
A、C为F元素,无正价,最高价为0价,故A错误;
B、A为S元素,B为Mg元素,C为F元素,同周期原子半径从左到右逐渐减小,电子层数越多,半径越大,则有B>A>C,故B错误;
C、离子的电子层数越多,半径越大,具有相同核外电子结构的离子,核电荷数越大,半径越小,所以A2﹣>C﹣>B2+,故C正确;
D、元素的非金属性越强,对应阴离子的还原性越弱,则有A2﹣>C﹣,故D错误.
故选C.
点评: 本题考查原子结构与元素周期律的关系,题目难度不大,本题的关键是根据原子结构特点正确推断元素的种类.


科目:高中化学 来源: 题型:
近年来,为满足某些尖端技术的发展需要,人们又设计和合成了许多新型合金材料。如:储氢合金是一类能够大量吸收氢气,并与氢气结合成金属氢化物的材料。此外,________、________和________等新型合金广泛应用于卫星、航空航天、生物工程和电子工业等领域。
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C9H11Cl,且苯环上有两个取代基的芳香族化合物,其可能的结构有(不考虑立 体异构)
A. 5 种 B. 9 种 C. 12 种 D. 15 种
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语正确的是()
A. O原子的电子排布图为 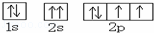
B. 氯化钠的分子式:NaCl
C. Cl﹣的结构示意图:
D. Ca原子的电子排布式为 1s22s22p63s23p63d2
查看答案和解析>>
科目:高中化学 来源: 题型:
以NA表示阿伏加德罗常数,下列说法错误的是()
A. 1mol P4中P﹣P键的数目为6NA
B. 1mol Na2O2晶体中含有阴阳离子总数为4NA
C. 30g SiO2晶体中含有Si﹣O键数目为2NA
D. 6g金刚石中含有的碳碳键数目为1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族,其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9,单质Y可与NaOH溶液反应生成氢气.下列说法不正确的是()
A. 原子半径:Y>Z>W
B. XW2熔点为107℃,沸点为142.5℃,说明固态XW2为分子晶体
C. 电解YW3固体可得单质Y
D. 
ZW2分子结构见右图,说明ZW2是极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中正确的是( )
|
| A. | 制取溴苯:将铁屑、溴水、苯混合加热 |
|
| B. | 实验室制取硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸 |
|
| C. | 鉴别甲苯和苯:向甲苯和苯中分别滴入酸性KMnO4溶液,振荡,观察是否褪色 |
|
| D. | 检验卤代烃中的卤原子:加入NaOH溶液共热,然后加入稀硝酸至溶液呈酸性,再加AgNO3溶液,观察沉淀的颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验 。
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。
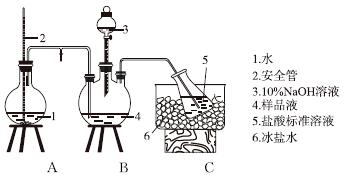
氨的测定装置(已省略加热和夹持装置)
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是__________________________________________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用________式滴定管,可使用的指示剂为________。
(3)样品中氨的质量分数表达式为________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将________(填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是____________________;滴定终点时,若溶液中c(Ag+)=2.0×10-5 mol·L-1,c(CrO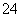 )为________mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
)为________mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
(6)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为________,制备X的化学方程式为______________________________________;X的制备过程中温度不能过高的原因是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com