
【题目】下列叙述正确的是 ![]()
A.某二元酸![]() 在水中的电离方程式是:
在水中的电离方程式是:![]() ,
,![]() ;则NaHA溶液中:
;则NaHA溶液中:![]()
B.相同温度下将足量氯化银固体分别放入相同体积的①蒸馏水、②![]() 盐酸、③
盐酸、③![]() 氯化镁溶液、④
氯化镁溶液、④![]() 硝酸银溶液中,
硝酸银溶液中,![]() 为①>④=②>③
为①>④=②>③
C.常温下,某溶液的![]() ,则该物质一定是酸或强酸弱碱盐
,则该物质一定是酸或强酸弱碱盐
D.若![]() 、
、![]() 、
、![]() 分别表示常温下
分别表示常温下![]() 的电离平衡常数、
的电离平衡常数、![]() 的水解平衡常数和水的离子积常数,则三者之间的关系为
的水解平衡常数和水的离子积常数,则三者之间的关系为![]()
 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白。NaClO2在溶液中可生成ClO2、HClO2、ClO2-、Cl-等四种含氯微粒,经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则下列分析不正确的是

A. 亚氯酸钠在碱性条件下较稳定
B. 25℃时,HClO2的电离平衡常数的数值Ka=10-6
C. 25℃,pH=3时NaClO2溶液中c(Na+)+c(H+)=c(ClO2-)+c(OH-)
D. 若浓度均为0.1mol/L的HClO2溶液和NaClO2溶液等体积混合后所得溶液显酸性,溶液中有关微粒的浓度由大到小的顺序为c(ClO2-)>c(Na+)>c(HClO2)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应3H2+N2![]() 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是( )
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是( )
A.υ正(N2)=υ正(H2)B.υ正(N2)=υ逆(NH3)C.3υ正(H2)=2υ逆(NH3)D.3υ正(N2)=υ逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为短周期元素,若W原子的最外层电子数是其内层电子的![]() ,如图所示,下列说法不正确的是
,如图所示,下列说法不正确的是
X | Y | |
Z | W |
A.X元素的氢化物分子间可以形成氢键
B.Y元素的两种同素异形体常温下都是气体
C.阴离子半径从大到小的顺序为X>Y>Z>W
D.最高价氧化物对应的水化物的酸性:W>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,将
时,将![]() 的某一元酸HA与
的某一元酸HA与![]() 的NaOH溶液等体积混合,充分反应后所得溶液中部分离子浓度如下表。下列说法中正确的是
的NaOH溶液等体积混合,充分反应后所得溶液中部分离子浓度如下表。下列说法中正确的是![]()
微粒 |
|
|
|
浓度 |
|
|
|
A.所得溶液中:![]()
B.![]() 时,水的离子积
时,水的离子积![]()
C.![]() 时,一元酸HA的电离常数
时,一元酸HA的电离常数![]()
D.![]() 时,
时,![]() 溶液中
溶液中![]() 的水解率为
的水解率为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学能与热能的转化,某实验小组设计了如下图所示的三套实验装置:
Ⅰ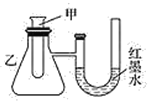 Ⅱ
Ⅱ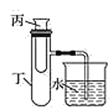 Ⅲ
Ⅲ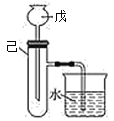
(1)上述装置中,不能验证“某固液不加热反应是吸热反应还是放热反应”的装置是______(填装置序号)。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管中加入适量金属锌与稀硫酸,U形管中可观察到的现象是_______。说明该反应属于___(填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在丙试管中进行)。
①若M为氢氧化钠,则实验过程中烧杯中可观察到的现象是_________。
②若观察到烧杯中导管产生一段水柱,则说明M溶于水_____(填“一定是放热反应”、“一定是吸热反应”、“可能是放热反应”、“可能是吸热反应”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上处理有机废水的一种方法是:在调节好pH和Mn2+浓度的废水中加入H2O2,使有机物氧化降解。现设计如下对比实验(实验条件见下左表),实验测得有机物R浓度随时间变化的关系如下图所示。下列说法正确的是

实验编号 | T/K | pH | c/10-3mol·L-1 | |
H2O2 | Mn2+ | |||
① | 298 | 3 | 6.0 | 0.30 |
② | 313 | 3 | 6.0 | 0.30 |
③ | 298 | 9 | 6.0 | 0.30 |
A. 313K时,在0~100s内有机物R降解的平均速率为:0.014 mol·L-1·s-1
B. 对比①②实验,可以得出温度越高越有利于有机物R的降解
C. 对比①②实验,可以发现在两次实验中有机物R的降解百分率不同
D. 通过以上三组实验,若想使反应停止,可以向反应体系中加入一定量的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列说法正确的是
A.某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=a+1
B.在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液pH<7
C.NH4Cl溶液的Kw大于NaCl溶液的Kw
D.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子电池的应用很广,其正极材料可再生利用。某离子电池正极材料有钴酸锂(LiCoO2),导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为:6C+xLi++xe-=LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件末给出)。
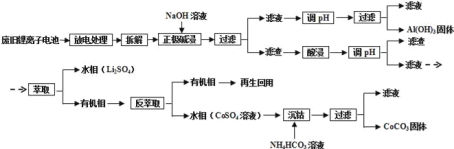
(1) LiCoO2中,Co元素的化合价为____________。
(2)写出“正极碱浸”中发生反应的离子方程式_____________________________________。
(3)采用H2SO4和H2O2的混合液进行“酸浸”,一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式:__________________________________________。可用盐酸代替H2SO4和H2O2的混合液,但缺点是___________________________。
(4)写出“沉钴“过程中发生反应的化学方程式_________________________________。
(5)充放电过程中,发生LiCoO2与LixCoO2之同的转化,写出放电时电池反应方程式_________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com