
| A. | 澄清石灰水与稀硝酸反应 | B. | 硫在氧气中燃烧 | ||
| C. | 钠粒与稀盐酸反应 | D. | 碳酸氢钠溶液与氢氧化钠溶液反应 |
分析 根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应,再结合中和反应的特点来回答.
解答 解:A、澄清石灰水与稀硝酸的反应生成硝酸钙和水,属于中和反应,反应释放热量,故A正确;
B、硫在氧气中燃烧的反应属于放热反应,但是不属于中和反应,故B错误;
C、钠粒与稀盐酸反应属于放热反应,但是不属于中和反应,故C错误;
D、碳酸氢钠溶液与氢氧化钠溶液反应碳酸钠和水,反应不属于放热反应,故D错误.
故选A.
点评 本题考查放热反应,抓住中学化学中常见的吸热或放热的反应是解题的关键,对于特殊过程中的热量变化的要熟练记忆来解答此类习题.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属的电化学腐蚀比化学腐蚀更普遍 | |
| B. | 航海船船底四周镶嵌锌块保护船体,利用的是牺牲阳极保护法 | |
| C. | 用铝制铆钉连接铁板,铝钉易被腐蚀 | |
| D. | 原电池中电子由正扱流入负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g乙烯和环丁烷的混合气体中含有的碳原子数为2NA | |
| B. | 常温常压下,46gNO2和N2O4的混合气体中含有的原子数为3NA | |
| C. | 标准状况下,22.4L水中含有的质子数为10NA | |
| D. | 1molNa与足量的O2反应,生成Na2O和Na2O2的混合物,转移电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
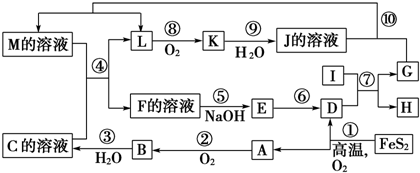
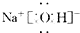
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaC03(s)=BaO(s)+CO2(g)在高温下能自发进行,推知△H>0 | |
| B. | 2CO(g)=2C(s)+O2(g)是吸热反应,推知该反应在低温下能自发进行 | |
| C. | 4NH3(g)+5O2(g)=4N0(g)+6H2O(g)是放热反应,推知该反应能自迸行 | |
| D. | N2(g)+3H2(g)=2NH3(g)是熵减的放热反应,推知该反应在低温下能自迸行,但在实际生产中,为了保证反应速率,常采用高温、高压、催化剂等条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
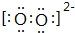 .
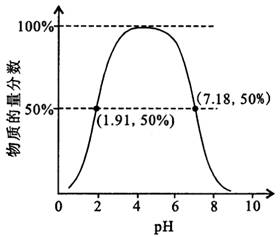
. 
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向上风口转移 | B. | 向下风口转移 | ||
| C. | 用湿毛巾捂住口鼻 | D. | 及时戴上用硫酸溶液湿润过的口罩 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
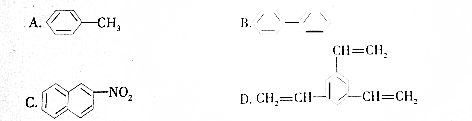
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 电化学原理在医学医疗中有重要应用.
电化学原理在医学医疗中有重要应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com