
 将5.3g某碱式碳酸盐固体(不含结晶水)M溶解于100g 9.8%的稀硫酸中,充分反应后得到224mL CO2(标准状况)和含有MgSO4、Al2(SO4)3的溶液.向所得溶液中逐滴加入NaOH溶液,产生沉淀的质量与加入的溶质NaOH的质量关系如图所示.
将5.3g某碱式碳酸盐固体(不含结晶水)M溶解于100g 9.8%的稀硫酸中,充分反应后得到224mL CO2(标准状况)和含有MgSO4、Al2(SO4)3的溶液.向所得溶液中逐滴加入NaOH溶液,产生沉淀的质量与加入的溶质NaOH的质量关系如图所示.分析 M溶解于100g 9.8%的稀硫酸中,n(H2SO4)=$\frac{100g×9.8%}{98g/mol}$=0.1mol,充分反应后得到224mL CO2(标准状况),n(CO2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,含有MgSO4、Al2(SO4)3的溶液,向所得溶液中逐滴加入NaOH溶液,由图可知,依次发生OH-+H+=H2O、3OH-+Al3+=Al(OH)3↓、2OH-+Mg2+=Mg(OH)2↓、OH-+Al(OH)3=AlO2-+2H2O,则氢氧化镁的物质的量为$\frac{3.48g}{58g/mol}$=0.06mol,氢氧化铝的物质的量为$\frac{5.04g-3.48g}{78g/mol}$=0.02mol,结合反应及原子守恒计算.
解答 解:M溶解于100g 9.8%的稀硫酸中,n(H2SO4)=$\frac{100g×9.8%}{98g/mol}$=0.1mol,充分反应后得到224mL CO2(标准状况),n(CO2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,含有MgSO4、Al2(SO4)3的溶液,向所得溶液中逐滴加入NaOH溶液,由图可知,依次发生OH-+H+=H2O、3OH-+Al3+=Al(OH)3↓、2OH-+Mg2+=Mg(OH)2↓、OH-+Al(OH)3=AlO2-+2H2O,则氢氧化镁的物质的量为$\frac{3.48g}{58g/mol}$=0.06mol,氢氧化铝的物质的量为$\frac{5.04g-3.48g}{78g/mol}$=0.02mol,
(1)由图可知,先发生OH-+H+=H2O,则硫酸剩余,可知固体M与稀硫酸反应后所得溶液中除含有溶质MgSO4和Al2(SO4)3外,还含有的溶质是H2SO4,
故答案为:H2SO4;
(2)加入的溶质NaOH从0.8g到xg所发生反应的离子方程式为3OH-+Al3+=Al(OH)3↓、2OH-+Mg2+=Mg(OH)2↓,故答案为:3OH-+Al3+=Al(OH)3↓、2OH-+Mg2+=Mg(OH)2↓;
(3)当加入溶质NaOH的质量到xg时,生成Al(OH)3的质量为5.04g-3.48g=1.56g,由
3OH-+Al3+=Al(OH)3↓
0.06mol 0.02mol
2OH-+Mg2+=Mg(OH)2↓
0.12mol 0.06mol
则生成沉淀消耗NaOH为0.18mol×40g/mol=7.2g,则x=7.2g+0.8g=8.0g,
故答案为:1.56g;8.0;
(4)由原子守恒可知,n(Mg)=0.06mol,n(Al)=0.02mol,n(CO32-)=0.01mol,n(OH-)=$\frac{5.3g-0.06mol×24g/mol-0.02mol×27g/mol-0.01mol×60g/mol}{17g/mol}$=0.16mol,n(Mg):n(Al):n(CO32-):n(OH-)=6:2:1:16,
则碱式碳酸盐的化学式为Al2Mg6(OH)16CO3,故答案为:Al2Mg6(OH)16CO3.
点评 本题考查物质M组成的推断,涉及离子反应方程式及图象的分析,为高频考点,把握发生的离子反应及图象中对应的离子反应为解答的关键,侧重分析、应用及计算能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②④ | C. | ②③ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三月考二化学试卷(解析版) 题型:推断题
有机化学反应因反应条件不同,可生成不同的有机产品。例如:

工业上利用上述信息,按下列路线合成结构简式为 的物质,该物质是一种香料。
的物质,该物质是一种香料。

请根据上述路线,回答下列问题:
(1)A的结构简式可能为 。
(2)反应③、⑤的反应类型分别为 、 。
(3)反应④的化学方程式为(注明反应条件): 。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是___________。
(5)这种香料是具有多种同分异构体,其中某种物质有下列性质:
①该物质的水溶液遇FeCl3溶液呈紫色
②分子中有苯环,且苯环上的一溴代物有两种。
写出符合上述两条件的物质可能的结构简式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2与水反应:Na2O2+2H20═2Na++2OH-+H2↑ | |
| B. | FeSO4溶液与H2O2溶液混合:Fe2++H2O2+2H+═Fe3++2H2O | |
| C. | 向Na2SiO3溶液中通人过量的SO2:SiO32-+SO2+H2O═Na2SiO3↓+SO32- | |
| D. | NH4HCO3稀溶液与过量的Ca(OH)2溶液混合:NH4++HC03-+Ca2++2OH-═CaCO3↓+NH3•H2O+H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由X、Y、Z组成的化合物既能与强碱溶液反应,又能与强酸溶液反应 | |
| B. | W的氢化物水溶液是强酸 | |
| C. | Y元素的氢化物在同周期中是最稳定的 | |
| D. | 元素Y和W只能形成一种化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C8H16O2 | B. | C8H16O3 | C. | C8H14O2 | D. | C8H14O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
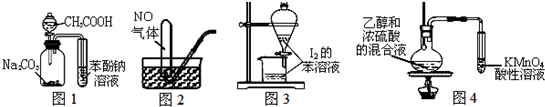
| A. | 图1证明酸性:CH3COOH>H2CO3>苯酚 | |
| B. | 图2用排水法收集NO | |
| C. | 图3萃取碘水中I2,分出水层后的操作 | |
| D. | 图4验证乙烯的生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com