
将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入HCl气体6.72L(标准状况),若忽略反应过程中溶液的体积变化,则下列判断正确的是 ( )
A.反应过程中得到6.72L(标准状况)的气体
B.最终无沉淀生成
C.最终得到的溶液中c(NaCl)=1.5mo/L
D.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
科目:高中化学 来源:2015-2016学年河北省唐山市高一下期末文科化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.烃是指含有碳、氢元素的有机物
B.燃烧后能产生CO2和H2O的有机物一定是烃
C.天然气、沼气、坑气、煤气的主要成分都是甲烷
D.形成化合物种类最多的元素位于周期表中第二周期第IVA族
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省大连市高二下期末化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.SO2和Cl2都能使品红溶液褪色,且加热后均恢复原色
B.SiO2是酸性氧化物,能与NaOH溶液反应
C.紫色石蕊试液滴入SO2水溶液中,先变红后褪色
D.向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,则该溶液中一定含有SO42-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二下期未化学试卷(解析版) 题型:选择题
分子式为C4H10O并能与金属钠反应放出氢气的有机化合物有:( )
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二下期未化学试卷(解析版) 题型:选择题
氯酸质量分数超过40%时会发生分解,反应可表示为:8 HClO3 = 3 O2↑+ 2 Cl2↑+ 4 HClO4 + 2 H2O,下列说法正确的是( )
A.氧化性比较HClO4 > HClO3
B.氧化产物只有HClO4
C.氯酸分解后的混合气体平均相对分子质量为47.6
D.该反应转移电子数为12e—
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省长沙市高二下期末理科化学试卷(解析版) 题型:实验题
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用如图所示装置制备亚氯酸钠。
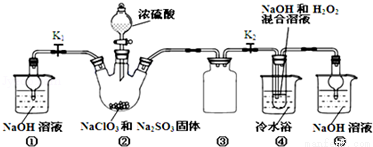
完成下列填空:
(1)装置②中产生ClO2的化学方程式为 .装置③的作用是 ;
(2)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;② ;③ ;④低于60℃干燥,得到成品.(选择合适的操作编号填空)
A.冷却到室温后,过滤
B.趁热过滤
C.常温洗涤
D.冰水洗涤
E.38~60℃的温水洗涤
(3)准确称取所得亚氯酸钠样品10g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再 滴入适量的稀硫酸,充分反应(ClO2﹣+4I﹣+4H+═2H2O+2I2+Cl﹣).将所得混合液配成250mL待测溶液.配制待测液需用到的定量玻璃仪器是 ;
滴入适量的稀硫酸,充分反应(ClO2﹣+4I﹣+4H+═2H2O+2I2+Cl﹣).将所得混合液配成250mL待测溶液.配制待测液需用到的定量玻璃仪器是 ;
(4)取25.00mL待测液,用2.0mol/L Na2S2O3标准液滴定(I2+2S2O32﹣═2I﹣+S4O62﹣),以淀粉溶液做指示剂,达到滴定终点时的现象为 ___________________________。重复滴定2~3次,测得所用Na2S2O3溶液体积的平均值为20.00mL。该样品中NaClO2的质量分数为 。
(5)Na2FeO4和ClO2在水处理过程中分别被还原为Fe3+和Cl﹣.如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > > 。(填化学式)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省长沙市高二下期末理科化学试卷(解析版) 题型:选择题
常温下,下列各组离子能大量共存的是
A.pH=12的溶液中:K+、Na+、Br-、AlO
B.无色溶液中:MnO、H+、K+、C2O
C.c(Fe3+)=0.1 mol·L-1的溶液中:K+、H+、SCN-、I-
D.由水电离出的c(OH-)=1.0×10-13 mol·L-1的溶液中:Na+、NH、SO、HCO
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省益阳市高一下期末化学试卷(解析版) 题型:选择题
为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是( )
序号 | 不纯物 | 除杂试剂 | 分离方法 |
A | CH4(C2H4) | 酸性KMnO4溶液 | 洗气 |
B | 苯(Br2) | NaOH溶液 | 过滤 |
C | C2H5OH(H2O) | 新制生石灰 | 蒸馏 |
D | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省济宁市高一下期末化学试卷(解析版) 题型:填空题
四种短周期元素A、B、C、D的性质或结构信息如下:
信息:①原子半径:A>B>C>D ②四种元素之间形成的某三种分子的比例模型及部分性质如下:
甲: 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二。
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二。
乙: 无色,无气味并且易燃。是常见的一种基础能源。
无色,无气味并且易燃。是常见的一种基础能源。
丙: 有强氧化性的弱酸,可以用于消毒杀菌。
有强氧化性的弱酸,可以用于消毒杀菌。
请根据上述信息回答下列问题。
(1)B元素在元素周期表中的位置为________________,请写出BC2分子的电子式:_______________。
(2)A所在周期中,E元素的单质还原性最强,F元素的某些盐类常用作净水剂。E单质与甲反应有化合物X生成。请写出以下两个反应的离子方程式:
①A元素的单质与物质甲发生反应:_____________________________________。
②F、C两种元素组成的化合物Y可作为高温结构陶瓷材料,X与Y两种化合物在溶液中发生反应:______________________________________________________。
(3)物质丁的元素组成和甲相同,丁分子具有18电子结构。向盛有一定浓度丁溶液的试管中,逐滴加入硫酸酸化的硫酸亚铁溶液。滴加过程中的现象为:
①试管中溶液变成深棕黄色,发生反应的离子方程式为 ;
②开始有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,继续滴加溶液,静置一段时间,试管底部出现红褐色沉淀。请回答“片刻后反应变得剧烈”的原因是a b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com