
 �й���Ϣ���£�������ͨ��������Ϊ��ɫҺ�壬�۵�Ϊ-54.1�棬�е�Ϊ69.1�棬�ڳ�ʪ�����С����̡���100�����Ͽ�ʼ�ֽ⣬���ɶ�����������������ڷ���Ҳ�ᷢ���ֽ⣮�ش��������⣺
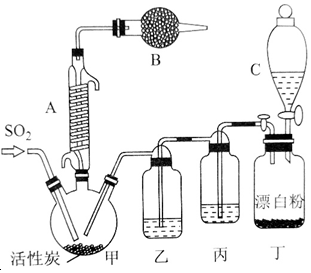
�й���Ϣ���£�������ͨ��������Ϊ��ɫҺ�壬�۵�Ϊ-54.1�棬�е�Ϊ69.1�棬�ڳ�ʪ�����С����̡���100�����Ͽ�ʼ�ֽ⣬���ɶ�����������������ڷ���Ҳ�ᷢ���ֽ⣮�ش��������⣺���� ��1�����������Ĺ�����ж�װ�ü�������A�����ƣ��÷�Ӧ��Ҫ����������л���̿�������Ǵ������������ڳ�ʪ�����С����̡����������к���ˮ������
��2��װ�ö����ṩ�����ģ���������Һ��Ư������������������������
��3���Ȼ��ᣨC1SO3H�����ȷֽ⣬Ҳ���Ƶ�������������һ�����ʣ�����ԭ���غ��֪��һ�������������������ͨ��������Ϊ��ɫҺ�壬�۵�Ϊ-54.1�棬�е�Ϊ69.1�棬������е�ߣ�
��4�����ɵ������к����Ȼ��⣻�����Ͷ���������ܷ�����Ӧ�������
��5������������ͨ��������Ϊ��ɫҺ�壬�۵�Ϊ-54.1�棬�е�Ϊ69.1�棬�ڳ�ʪ�����С����̡���100�����Ͽ�ʼ�ֽ⣬���ɶ�����������������ڷ���Ҳ�ᷢ���ֽ⣮
��� �⣺��1�����������Ĺ�����ж�װ�ü�������A������Ϊ�����ܻ����������ܻ��������ܣ��÷�Ӧ��Ҫ����������л���̿�������Ǵ������������ڳ�ʪ�����С����̡����������к���ˮ��������װ��B�����������տ�����ˮ������������δ��Ӧ�Ķ�����������������ֹ��Ⱦ������
�ʴ�Ϊ�������ܻ����������ܻ��������ܣ������� ���տ�����ˮ������������δ��Ӧ�Ķ�����������������ֹ��Ⱦ������
��2��װ�ö����ṩ�����ģ���������Һ��Ư��������������������������װ�ö��з�����Ӧ�����ӷ���ʽΪCl-+ClO-+2H+=Cl2��+H2O��
�ʴ�Ϊ��Cl-+ClO-+2H+=Cl2��+H2O��
��3���Ȼ��ᣨClSO3H�����ȷֽ⣬Ҳ���Ƶ�������������һ�����ʣ�����ԭ���غ��֪��һ�������������ᣬ��˸÷�Ӧ�Ļ�ѧ����ʽΪ2ClSO3H $\frac{\underline{\;\;��\;\;}}{\;}$SO2Cl2+H2SO4��������ͨ��������Ϊ��ɫҺ�壬�۵�Ϊ-54.1�棬�е�Ϊ69.1�棬������е�ߣ���������ķ�����������C��ȷ��
�ʴ�Ϊ��2ClSO3H $\frac{\underline{\;\;��\;\;}}{\;}$SO2Cl2+H2SO4��C��
��4�����ɵ������к����Ȼ��⣬����װ�ñ�������Ϊ��ȥHCl���壮��������ǿ�����ԣ�������SO2��װ�����Ǹ��������ģ������ȱ��װ���ң������Ͷ���������ܷ�����Ӧ�Ļ�ѧ����ʽΪSO2+Cl2+2H2O=H2SO4+2HCl���ʴ�Ϊ����ȥHCl���壻 SO2+Cl2+2H2O=H2SO4+2HCl��
��5������������ͨ��������Ϊ��ɫҺ�壬�۵�Ϊ-54.1�棬�е�Ϊ69.1�棬�ڳ�ʪ�����С����̡���100�����Ͽ�ʼ�ֽ⣬���ɶ�����������������ڷ���Ҳ�ᷢ���ֽ⣬���Ϊ��߱�ʵ���������ȵIJ��ʣ���ʵ���������Ҫע��������Т���ͨ����ˮ����ͨ�����ڿ����������ʣ��������˿죬����������ƿ���̣����ʵ����£������ܼ���������ƿ���������ٷֽ⣬�٢ڢ���ȷ���ʴ�Ϊ���٢ڢۣ�
���� ���⿼���Ʊ�ʵ�鷽������ƣ�Ϊ��Ƶ���㣬�����Ʊ�ԭ����ʵ��װ�õ����á�ʵ�鼼��Ϊ���Ĺؼ������ط�����ʵ�������Ŀ��飬��Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �ڢܢݢ� | C�� | �٢ڢ� | D�� | �٢ڢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ԫ�ص�������Ϊ5��4 | B�� | �κ����������Ⱦ�Ϊ1��1 | ||
| C�� | ���е�O2��O3��������֮��Ϊ1��1 | D�� | SO2��SO3��������֮��Ϊ1��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
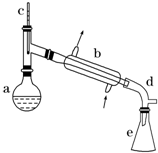 ����ˮ�Ǻϳ�ϩ���ij��÷�����ʵ���Һϳɻ���ϩ�ķ�Ӧ��ʵ��װ�����£�
����ˮ�Ǻϳ�ϩ���ij��÷�����ʵ���Һϳɻ���ϩ�ķ�Ӧ��ʵ��װ�����£�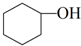 $��_{��}^{Ũ����}$
$��_{��}^{Ũ����}$ +H2O
+H2O| ��Է������� | �ܶ�/��g•cm-3�� | �е�/�� | �ܽ��� | |
| ������ | 100 | 0.961 8 | 161 | ����ˮ |
| ����ϩ | 82 | 0.810 2 | 83 | ������ˮ |
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
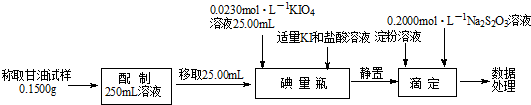
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
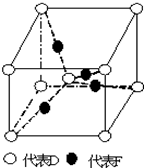 �����ڱ���1��36��֮���A��B��C��D��E��F����Ԫ�أ����ǵ�ԭ����������������֪A����������Ԫ�ؼȲ�ͬ����Ҳ��ͬ���壬B��һ�ֺ����ڿ���ʱ����������һЩ����������CԪ��ԭ�ӵ��������3������������ͬ��δ�ɶԵ��ӣ�Dԭ�Ӻ��������8�ֲ�ͬ���˶�״̬��EԪ���ڵ������ڣ�E�Ļ�̬ԭ����δ�ɶԵ������Ǻ������������$\frac{1}{4}$��FԪ��λ�����ڱ���ds�������̬ԭ�������ܲ�ֻ��һ�����ӣ�
�����ڱ���1��36��֮���A��B��C��D��E��F����Ԫ�أ����ǵ�ԭ����������������֪A����������Ԫ�ؼȲ�ͬ����Ҳ��ͬ���壬B��һ�ֺ����ڿ���ʱ����������һЩ����������CԪ��ԭ�ӵ��������3������������ͬ��δ�ɶԵ��ӣ�Dԭ�Ӻ��������8�ֲ�ͬ���˶�״̬��EԪ���ڵ������ڣ�E�Ļ�̬ԭ����δ�ɶԵ������Ǻ������������$\frac{1}{4}$��FԪ��λ�����ڱ���ds�������̬ԭ�������ܲ�ֻ��һ�����ӣ� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
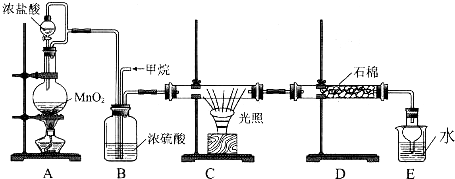
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com