
| A. | 向煮沸的1mol/L NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 | |
| B. | 用氢氧化铜粉末检验尿糖 | |
| C. | 用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸 | |
| D. | 用醋和澄清石灰水验证蛋壳中含有碳酸盐 |
分析 A.向沸腾的NaOH稀溶液中滴加FeCl3,生成Fe(OH)3沉淀;
B.利用氢氧化铜悬浊液来检验尿糖;
C.乙醇和乙酸的反应为可逆反应;
D.醋酸与碳酸盐反应生成二氧化碳,二氧化碳可使澄清石灰水变浑浊.
解答 解:A.实验室制备氢氧化铁胶体,是在沸腾的蒸馏水中加入饱和氯化铁溶液加热,当溶液变为红褐色时应立即停止加热,即可以得到氢氧化铁胶体,故A错误;
B.利用氢氧化铜悬浊液来检验尿糖,并注意实验在碱性条件下进行,故B错误;
C.乙醇和乙酸的反应为可逆反应,用乙醇和浓硫酸不能除去乙酸乙酯中的少量乙酸,并引入了新的杂质,故C错误;
D.醋酸与碳酸盐反应生成二氧化碳,二氧化碳可使澄清石灰水变浑浊,可用于检验,故D正确.
故选D.
点评 本题考查物质的分离、提纯、鉴别和胶体的制备,题目难度不大,注意向沸腾的NaOH稀溶液中滴加FeCl3,生成Fe(OH)3沉淀.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:解答题
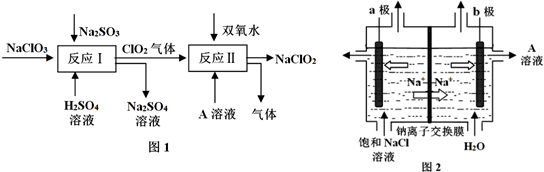
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ═2CuI↓+13I2+□K2SO4+□
═2CuI↓+13I2+□K2SO4+□ ,生成的I2刚好消耗n mol S2O32-(S2O32-被氧化为S4O62-),则参加反应的Cu(IO3)2物质的量为( )
,生成的I2刚好消耗n mol S2O32-(S2O32-被氧化为S4O62-),则参加反应的Cu(IO3)2物质的量为( )| A. | $\frac{n}{10}$ mol | B. | $\frac{n}{11}$ mol | C. | $\frac{n}{12}$ mol | D. | $\frac{n}{13}$ mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,将相同的铝片分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | AgCl沉淀中滴加Na2S溶液可以得到Ag2S沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯制溴苯、乙烯制乙醇 | |
| B. | 甲烷制一氯甲烷、苯制硝基苯 | |
| C. | 乙醇制乙醛、乙醇和乙酸制乙酸乙酯 | |
| D. | 苯制环己烷、乙酸乙酯水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;若生成4.29g Cu2(OH)3Cl,则理论上耗氧体积为0.448L(标准状况).
为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;若生成4.29g Cu2(OH)3Cl,则理论上耗氧体积为0.448L(标准状况).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物:干冰,冰水混合物,烧碱,小苏打 | |
| B. | 非电解质:乙醇,四氯化碳,氯气,葡萄糖 | |
| C. | 同素异形体:活性炭,C60,C80,金刚石 | |
| D. | 混合物:漂白粉,纯净矿泉水,分析纯盐酸,石灰石 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 E的氢化物的电子式
E的氢化物的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①<②<③<④<⑤ | B. | ④<②<①<③<⑤ | C. | ②<④<③<①<⑤ | D. | ②<④<①<③<⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com