
| A、纯水在25℃和100℃时的pH |
| B、CH3COONa溶液中Na+和CH3COO-的浓度 |
| C、相同温度下,0.1 mol/LCH3COOH溶液和0.3 mol/LCH3COOH溶液的电离平衡常数 |
| D、用0.1 mol/LNaOH溶液分别中和pH、体积均相同的盐酸和醋酸,所消耗NaOH溶液的体积 |


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
| ||
| 450℃ |
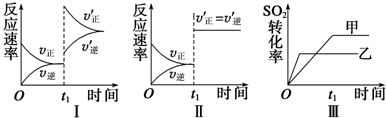
| A、图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响 |
| B、图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响 |
| C、图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高 |
| D、图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
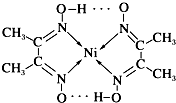 .对该物质的分析判断正确的是( )
.对该物质的分析判断正确的是( )| A、该物质是一个离子化合物 |
| B、该物质的分子中只含有共价键、配位键两种作用力 |
| C、该物质是一种配合物,其中Ni原子为中心原子 |
| D、该物质中C、N、O原子存在孤对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化镁是优质耐高温材料 |
| B、家庭用的铝锅不宜用碱水洗涤,也不宜用来蒸煮酸的食物 |
| C、常温下,铝片放入浓硝酸中发生剧烈反应 |
| D、镁可用于制造照明弹 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀释溶液,水解平衡常数增大 | ||
| B、通入H2S,HS-浓度增大 | ||
C、升高温度,
| ||
| D、加入NaOH固体,溶液pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通常,同周期元素的第一电离能ⅦA族的元素最大 |
| B、主族元素的原子形成单原子离子时的化合价数都和它的族序数相等 |
| C、第ⅠA、ⅡA族元素的原子,其半径越大,第一电离能越大 |
| D、在同一主族中,自上而下第一电离能逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Mg(HCO2)3溶液中滴加过量的NaOH溶液的离子方程式:Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O | ||||||||||
| B、向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀的离子方程式:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3?H2O+2BaSO4↓ | ||||||||||
| C、用稀醋酸除去铜绿的离子方程式:4H++Cu2(OH)2CO3=2Cu2++CO2↑+3H2O | ||||||||||
D、已知:
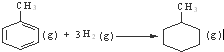 的△H为-384 kJ?mol-1 的△H为-384 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
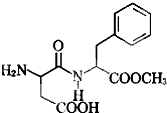 阿斯巴甜具有清爽的甜味,其结构简式如图所示.下列关于阿斯巴甜的说法中,不正确的是( )
阿斯巴甜具有清爽的甜味,其结构简式如图所示.下列关于阿斯巴甜的说法中,不正确的是( )| A、一定条件下可以发生酯化反应和加成反应 |
| B、完全水解,生成两种有机物 |
| C、阿斯巴甜属于糖类化合物 |
| D、在酸性条件下可以水解生成两种氨基酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com