
分析 (1)依据Cl-+Ag+═AgCl↓计算Cl-的物质的量,从而得出氯化物的物质的量,再利用M=$\frac{m}{n}$及摩尔质量与相对分子质量的数值相等来计算X的质量数;
(2)利用中子数+质子数=质量数,计算质子数,据此写出其在周期表中的位置.
解答 解:(1)n(AgNO3)=0.02L×1mol•L-1=0.02mol,即银离子的物质的量为0.02mol,由Cl-+Ag+═AgCl↓可知,硝酸银溶液20mL能把氯离子完全沉淀下来,则Cl-的物质的量为0.02mol,XCl2的物质的量为0.01mol,则XCl2的摩尔质量为$\frac{1.11g}{0.01mol}$=111g/mol,其相对分子质量为111,则X的质量数为111-35.5×2=40;
答:X的质量数为为40;
(2)x的中子数为20,所以X的质子数为40-20=20,为钙元素,位于周期表第四周期,第ⅣA族;
答:X元素在第四周期,第ⅣA族.
点评 本题考查了有关方程式的计算及元素在周期表中位置判断,熟悉发生的反应、原子中质量数、中子数、质子数之间的关系是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y元素为Na元素 | B. | X只能位于第3周期 | ||
| C. | a+n-b+m=10或16 | D. | Y不可能位于第2周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其钠盐的化学式为Na2X | B. | 最高价氧化物对应水化物为碱 | ||
| C. | X是金属元素 | D. | X单质是能导电的固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M与X形成的化合物对应的水化物一定是强酸 | |
| B. | Y2X和Y2X2中化学键类型完全相同 | |
| C. | X、Y的简单离子半径:r(X2-)>r(Y+) | |
| D. | M的气态氢化物比N的气态氢化物稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 是离子化合物,含有离子键和共价键 | |
| B. | 电子式是 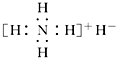 | |
| C. | 与水反应时,它既是还原剂又是氧化剂 | |
| D. | 固体投入少量的水中,有两种气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
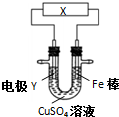
| A. | 若X为直流电源,Y为铜棒接正极,则Fe棒上镀铜 | |
| B. | 若X为直流电源,Y为碳棒接负极,则Fe棒被保护 | |
| C. | 若X为电流计,Y为锌棒,则SO42- 移向Fe棒 | |
| D. | 若X为导线,Y为铜棒,则Fe棒发生还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com