
| A. | NaHS在水中的电离方程式为:NaHS═Na++H++S2- | |
| B. | 已知某温度下Ksp(CH3COOAg)=2.8×10-3,此温度下浓度均为0.1 mol•L-1的AgNO3溶液和CH3COONa溶液等体积混合一定能产生CH3COOAg沉淀 | |
| C. | 0.1mol/L CH3COOH溶液与0.05mol/L NaOH溶液等体积混合,所得溶液中:2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) | |
| D. | 0.2mol/LNH3•H2O溶液与0.1mol/L盐酸等体积混合后,溶液显碱性,则:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
分析 A.NaHS为强电解质,完全电离,HS-部分电离;
B.根据Ksp(AgCl)以及Ksp(Ag2CrO4),当离子的浓度幂之积大于溶度积时,生成沉淀;
C.0.1mol/L CH3COOH溶液与0.05mol/L NaOH溶液等体积混合,所得溶液中为等浓度的醋酸钠和醋酸,依据溶液中电荷守恒和物料守恒计算分析判断;
D.0.2mol/LNH3•H2O溶液与0.1mol/L盐酸等体积混合后,得到等浓度的溶一水合氨和氯化铵混合溶液,一水合氨电离大于铵根离子水解溶液显碱性.
解答 解:A.NaHS为强电解质,完全电离,HS-部分电离,电离方程式为NaHS=Na++HS-和HS-?H++S2-,故A错误;
B.AgNO3溶液和CH3COONa溶液等体积混合浓度均为0.05mol•L-1,c(CH3COO-)×c(Ag+)=0.0025<2.8×10-3,一定不产生CH3COOAg沉淀,故B错误;
C.0.1mol/L CH3COOH溶液与0.05mol/L NaOH溶液等体积混合,所得溶液中为等浓度的醋酸钠和醋酸,溶液中存在电荷守恒:c(H+)+c(Na+)=c(CH3COO-)+c(OH-),2c(Na+)=c(CH3COO-)+c(CH3COOH),带入计算得到:2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-),故C正确;
D.0.2mol/LNH3•H2O溶液与0.1mol/L盐酸等体积混合后,得到等浓度的溶一水合氨和氯化铵混合溶液,一水合氨电离大于铵根离子水解溶液显碱性,溶液中离子浓度大小为c(NH4+)>c(Cl-)>c(OH-)>c(H+),故D错误;
故选C.
点评 本题考查了电解质溶液中化学反应产物判断,电解质溶液中电荷守恒、物料守恒分析,弱电解质电离平衡影响因素等知识点,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 肯定不能确定该物质的最简式 | B. | 肯定能确定该物质的最简式 | ||
| C. | 肯定不能确定该物质的分子式 | D. | 肯定不能确定该物质的结构式 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
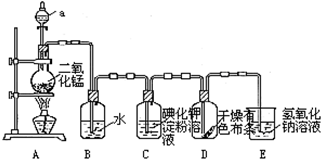
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
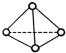 科学家己获得了极具理论研究意义的N4分子,其结构为正四面体型(如图所示),分子中每个氮原子最外电子层都满足8电子结构.己知断裂1mol N-N键吸收192kJ热量,断梨1mol N-N键吸收946kJ热量,则下列叙述中正确的是( )
科学家己获得了极具理论研究意义的N4分子,其结构为正四面体型(如图所示),分子中每个氮原子最外电子层都满足8电子结构.己知断裂1mol N-N键吸收192kJ热量,断梨1mol N-N键吸收946kJ热量,则下列叙述中正确的是( )| A. | 1molN4气体转化为N2时要吸收206 kJ能量 | |
| B. | N4是一种比N2更稳定的分子 | |
| C. | 1molN4气体转化为N2时要放出740 kJ能量 | |
| D. | N4是N2的同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com