
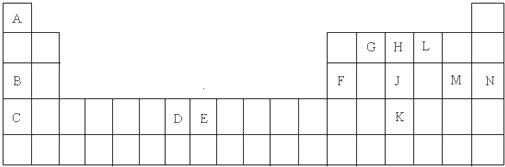
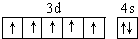
| A�� | �÷�Ӧ�е�Ԫ�ر����� | |
| B�� | �÷�Ӧ��H2O2����ԭ�� | |
| C�� | ʵ��������NaCN��Һʱ�������������NaOH��Һ | |
| D�� | �����£�Ũ�Ⱦ�Ϊ0.1 mol•L-1 NaCN��NaHCO3��Һ��ǰ�ߵ�pHС�ں��� |
���� NaCN+H2O2+H2O=NaHCO3+NH3����Ӧ��OԪ�ش�-1�۽���Ϊ-2�ۣ�CԪ�ش�+2�����ߵ�+4�ۣ���ϵ���ת�ƺ�NaCN�����ʷ�����
��� �⣺A��NaCN��CΪ+2�ۣ�NaΪ+1�ۣ���Ԫ�صĻ��ϼ�Ϊ-3����Ӧǰ��NԪ�ػ��ϼ۲��䣬��A����
B��NaCN+H2O2+H2O=NaHCO3+NH3����Ӧ��OԪ�ش�-1�۽���Ϊ-2�ۣ����Է�Ӧ��H2O2������������B����
C����ΪHCN���Ա�H2CO3��������ʵ��������NaCN��Һʱ�������������NaOH��Һ��ֹˮ�⣬��C��ȷ��
D����֪��HCN���Ա�H2CO3��������Խǿ���ε�ˮ��̶�ԽС������Һ��pHԽС������NaCN��NaHCO3��Һ��ǰ�ߵ�pH���ں��ߣ���D����
��ѡC��
���� ���⿼����������ԭ��Ӧ���ε�ˮ�⣬������������ԭ��Ӧ����ת�ƺ��������ʵĿ��飬ע��ӻ��ϼ۵ĽǶȷ�������Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �����仯�����У����������+7��
�����仯�����У����������+7��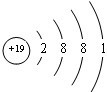 ��
��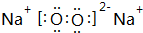 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������л�ԭ�ԣ������������ | |
| B�� | NaHCO3����Ӧ�����������Ƹ������ɼ� | |
| C�� | С�մ�����ᷴӦ������������θ������ҩ�� | |
| D�� | ̼������Һ�Լ��ԣ���������¯����ʱCaSO4������ת���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C��N��O��F | B�� | Li��C��N��S | C�� | Li��Na��Be��Mg | D�� | F��Cl��Br��I |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
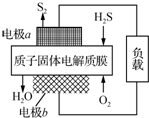 H2S������Դ������;��֮һ�ǻ����������õ�������Ӧԭ��Ϊ��2H2S��g��+O2��g���TS2��s��+2H2O��l����H=-632kJ•mol-1����ͼΪ����ĤH2Sȼ�ϵ�ص�ʾ��ͼ������˵����ȷ���ǣ�������
H2S������Դ������;��֮һ�ǻ����������õ�������Ӧԭ��Ϊ��2H2S��g��+O2��g���TS2��s��+2H2O��l����H=-632kJ•mol-1����ͼΪ����ĤH2Sȼ�ϵ�ص�ʾ��ͼ������˵����ȷ���ǣ�������| A�� | �缫aΪ��ص����� | |
| B�� | �缫b�Ϸ����ĵ缫��ӦΪ��O2+2H2O+4e-�T4OH- | |
| C�� | ��·��ÿ����4 mol���ӣ�����ڲ��ͷ�632 kJ���� | |
| D�� | ÿ34 g H2S���뷴Ӧ����2 mol H+������Ĥ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ʯȼ��ȼ�պ�ҵ�����еĵ��������ǵ��¡�������������ԭ��֮һ | |
| B�� | ���Ʋ;߲��˳�ʱ�������ԡ����Ժ��̵�ʳ�� | |
| C�� | �ú������۵���С����ʳƷһ���ܷ��װ����ֹʳƷ���� | |
| D�� | ��ѧҩƷ�Ż𣬶�Ҫ������ˮ����ĭ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | IA | ��A | ��A | ��A | ��A | ��A | O | |
| 2 | �� | �� | �� | |||||
| 3 | �� | �� | �� | �� | �� | �� |
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com