
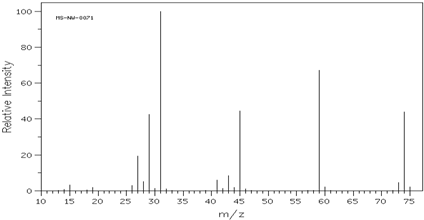
分析 某有机物含C、H、O三种元素,实验测得C、H、O三种元素的质量比为:24:5:8,可知n(C):n(H):n(O)=$\frac{24}{12}$:$\frac{5}{1}$:$\frac{8}{16}$=4:10:1,可知有机物实验式为C4H10O,由质谱图可知有机物相对分子质量为74,结合实验式可知分子式,由红外光谱图可知存在对称的甲基、对称的亚甲基和醚键可得分子结构,以此解答该题.
解答 解:(1)某有机物含C、H、O三种元素,实验测得C、H、O三种元素的质量比为:24:5:8,可知n(C):n(H):n(O)=$\frac{24}{12}$:$\frac{5}{1}$:$\frac{8}{16}$=4:10:1,可知有机物实验式为C4H10O,
故答案为:C4H10O;
(2)由质谱图可知有机物相对分子质量为74,设分子式为(C4H10O)x,则(4×12+10+16)x=74,x=1,则分子式为C4H10O,
故答案为:74;C4H10O;
(3)该有机物的相对原子质量为74,红外光谱图显示存在对称的甲基、对称的亚甲基和醚键可得分子的结构简式为:CH3-CH2-O-CH2-CH3,
故答案为:CH3-CH2-O-CH2-CH3;
(4)分子式为C4H10O的有机物,含有-OH则一定属于饱和一元醇,
丁基-C4H9可能的结构有:-CH2CH2CH2CH3、-CH(CH3)CH2CH3、-CH2CH(CH3)2、-C(CH3)3,丁基异构数目等于丁醇的异构体数目,则丁醇的可能结构有4种,分别为:CH3CH2CH2CH2OH、CH3CH2CH(CH3)OH、(CH3)2CHCH2OH、C(CH3)3OH,
故答案为:4.
点评 本题考查有机物结构的推断、核磁共振氢谱、红外光谱等,侧重考查学生分析推理能力、计算能力的考查,注意把握有机物同分异构体的判断,把握有机物结构的分析,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度不再发生变化 | |
| B. | 单位时间内生成nmolN2的同时生成3nmolH2 | |
| C. | N2、H2、NH3的浓度不再发生变化 | |
| D. | N2、H2、NH3的物质的量之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
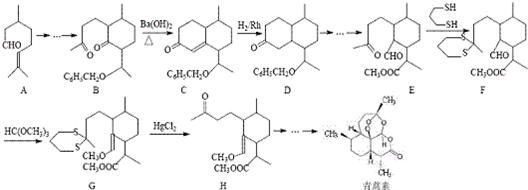
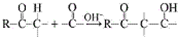
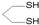 用系统命名法命名,它的名称是1,3-丙二硫醇;反应B→C,实际上可看作两步进行,依次发生的反应类型是加成反应、消去反应.
用系统命名法命名,它的名称是1,3-丙二硫醇;反应B→C,实际上可看作两步进行,依次发生的反应类型是加成反应、消去反应.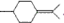 ,则异蒲勒醇的结构简式为:
,则异蒲勒醇的结构简式为: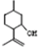 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 新鲜肉 | 次鲜肉 | 变质肉 | |
| pH | 5.8-6.2 | 6.3-6.6 | 6.7以上 |
| A. | 不变 | B. | 变强 | C. | 变弱 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
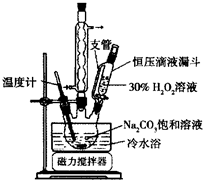 2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
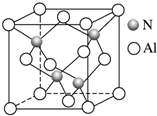 某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域.
某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com