I���̵���Ҫ��ʯ�����̿���Ҫ�ɷ�MnO
2�������̿���Ҫ�ɷ�MnCO
3���������̵�������ʽ��Ҫ�л�ʪ�����֣�
��1�����ȷ�Ӧ�ǻ����̷���֮һ���÷�Ӧ�Ļ�ѧ����ʽ��
��
��2�����̿������ʵ�������������仯ѧ����ʽ��
��
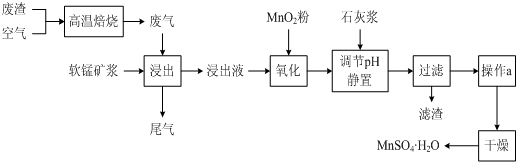
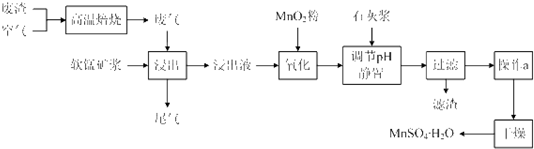
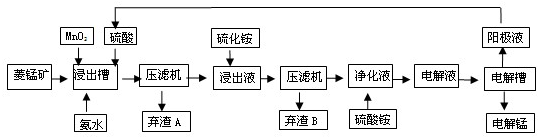
II��ʪ�����̼������������Һ��������̵��������̷�Ϊ���Ͻ�ȡ�������������������ӡ���Ʒ���գ������������������£�
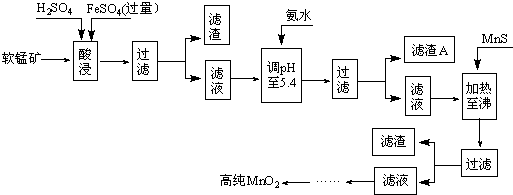
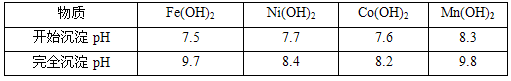
��֪�������̿�����Ҫ������Fe
2+��Co
2+��Ni
2+���������������pH���±���
| ���� |
Fe��OH��2 |
Ni��OH��2 |
Co��OH��2 |
Mn��OH��2 |
| ��ʼ����pH |
7.5 |
7.7 |
7.6 |
8.3 |
| ��ȫ����pH |
9.7 |
8.4 |
8.2 |
9.8 |
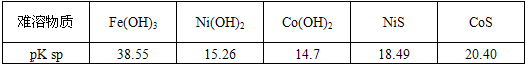
���й������������������pKsp���ݣ�pKsp=-lgKsp��
| �������� |
Fe��OH��3 |
Ni��OH��2 |
Co��OH��2 |
NiS |
CoS |
| pKsp |
38.55 |
15.26 |
14.7 |
18.49 |
20.40 |
��3��MnO
2�������dz�ȥ���̿�������ȡҺ�е�Fe
2+���ó��ӹ��̵����ӷ���ʽ��
��
��4��ʹ�ð�ˮ��Ŀ���ǵ���pHֵ��
����pH��Χ����ȷ��С�����1λ���֣����ڡ�����Һ���м�����淋�Ŀ����
��
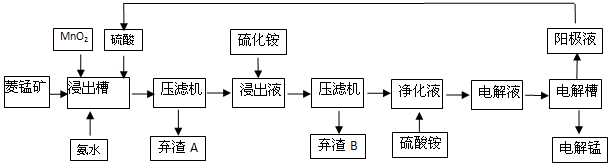
��5��������ʹ�õ��Ƕ��Ե缫�壬��ⷴӦ����ʽΪ
��




 ����������ϵ�д�
����������ϵ�д�