
压强对合成氨反应具有重要的影响。下表是反应达到平衡时压强与NH3含量的一些实验数据:
| 压强/MPa | 10 | 20 | 30 | 60 | 100 |
| NH3含量(体积分数)/% | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
从表中数据可以推断:随着压强增大,平衡时NH3含量
A.增加 B.减少 C.先增加,后减少 D.先减少,后增加
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
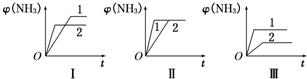
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| c2(NH3) |
| c(N2)c3(H2) |
| c2(NH3) |
| c(N2)c3(H2) |
| 1 |
| 12 |
| 1 |
| 12 |
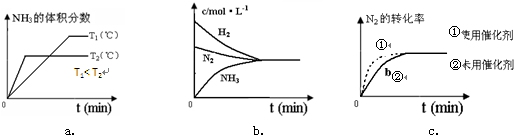
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
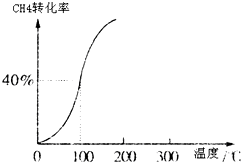 Ⅰ、合成氨对农业生产及国防建设均具有重要意义.
Ⅰ、合成氨对农业生产及国防建设均具有重要意义.| 1 | 2 |
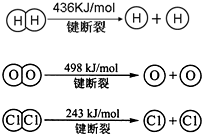
查看答案和解析>>
科目:高中化学 来源: 题型:
 2NH3(g);△H=-92.4kJ/mol
2NH3(g);△H=-92.4kJ/mol 2NH3(g);△H=-92.4kJ/mol
2NH3(g);△H=-92.4kJ/mol查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com