
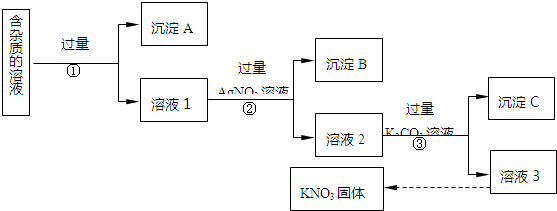
分析 利用含少量KCl、K2SO4、K2CO3杂质的KNO3溶液,得到纯净的KNO3固体,由流程可知,①中加过量的硝酸钡,与K2SO4、K2CO3反应生成沉淀A为BaSO4、BaCO3,滤液中含KCl、硝酸钡、KNO3,②中与过量硝酸银反应生成AgCl沉淀,溶液2中含硝酸钡、硝酸银、硝酸钾,③中与过量碳酸钾反应生成碳酸钡、碳酸银沉淀,溶液3中含硝酸钾、碳酸钾,应加硝酸再蒸发结晶、过滤得到硝酸钾,以此来解答.
解答 解:利用含少量KCl、K2SO4、K2CO3杂质的KNO3溶液,得到纯净的KNO3固体,由流程可知,①中加过量的硝酸钡,与K2SO4、K2CO3反应生成沉淀A为BaSO4、BaCO3,滤液中含KCl、硝酸钡、KNO3,②中与过量硝酸银反应生成AgCl沉淀,溶液2中含硝酸钡、硝酸银、硝酸钾,③中与过量碳酸钾反应生成碳酸钡、碳酸银沉淀,溶液3中含硝酸钾、碳酸钾,应加硝酸再蒸发结晶、过滤得到硝酸钾,
(1)由上述分析可知,沉淀A中含BaSO4、BaCO3,故答案为:BaSO4;BaCO3;
(2)②中反应的化学方程式AgNO3+KCl═AgCl↓+KNO3,故答案为:AgNO3+KCl═AgCl↓+KNO3;
(3)③分离不溶性固体与溶液,进行的实验操作是过滤,故答案为:过滤;
(4)③加入过量的K2CO3溶液的目的是除去Ba2+、Ag+,故答案为:Ba2+、Ag+;
(5)为了除去溶液3中的杂质,可向其中加入适量的稀硝酸.从此溶液获得KNO3晶体的操作是蒸发浓缩、冷却结晶、过滤,
故答案为:稀硝酸;蒸发浓缩;冷却结晶.
点评 本题考查混合物分离提纯,为高频考点,把握流程中的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入足量稀盐酸无沉淀,再加入氯化钡溶液后有白色沉淀产生,一定有SO42- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 无色试液加入NaOH溶液,试管口湿润的红色石蕊试纸未变蓝,结论:试液中无NH4+ | |
| D. | 无色溶液中加入稀盐酸产生无色气体,该气体能使澄清石灰水变浑浊,结论:原溶液一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室中铁和稀盐酸反应制取H2 | |
| B. | 实验室中用大理石和盐酸反应制取CO2 | |
| C. | 实验室中用氯酸钾加热分解制取 O2 | |
| D. | 实验室中用H2O2与MnO2混合制取O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能的大小:Mg>Al | |
| B. | 锗的第一电离能高于碳而电负性低于碳 | |
| C. | 前四周期的元素,核外电子中未成对的电子个数最多可以达到6个 | |
| D. | F、K、Fe、Ni四种元素中电负性最大的是F |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分别与足量盐酸反应时①消耗盐酸量少 | |
| B. | 分别与足量氯化钡溶液反应时①产生的沉淀多 | |
| C. | 分别配成等体积的溶液时②的c(Na+)大 | |
| D. | 相同条件下,分别与足量盐酸反应时放出的CO2体积相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com