
| A. | 农作物收获后,就地焚烧秸秆,增加土壤中钾肥含量 | |
| B. | 工业废水可经过“再生”处理,用于城市道路保洁、喷泉和浇花用水 | |
| C. | 硅单质常作为制备光导纤维的主要材料 | |
| D. | 淘米水中含有淀粉可以直接检测加碘盐中是否含有碘元素 |
分析 A.就地焚烧农作物秸秆,会产生有害气体和烟尘,污染大气;
B.工业废水经处理后可循环使用;
C.光导纤维主要成分是二氧化硅;
D.加碘盐中加入的是碘的化合物,不是碘单质;
解答 解:A.农作物收获后,就地焚烧秸秆,会产生有害气体和烟尘,污染大气,不利于环境保护,故A错误;
B.将工业废水“再生”处理,把废水变为较为纯净的水,可用于城市道路保洁、喷泉和浇花用水,故B正确;
C.光导纤维主要成分是二氧化硅,不是硅,故C错误;
D.碘与淀粉变蓝是指与碘单质与淀粉变蓝,而不是碘的化合物,而食盐加碘加入的是碘的化合物,故D错误;
故选:B.
点评 本题主要考查了化学在生产、生活中常见的环境污染与治理、二氧化硅、硅的用途,加碘盐的成分,难度不大,平时注意知识的积累.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:解答题
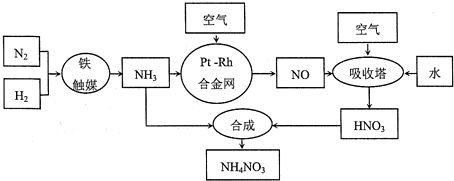
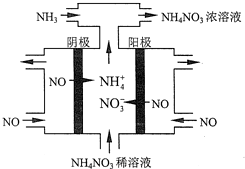
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 硝酸铵、氰化钠、电石和金属钠均属于电解质 | |
| B. | CN-中C元素显+2价,N元素显-3价,则非金属性N>C | |
| C. | 氰化钠是一种重要的化工原料,也是剧毒危险品,皮肤伤口接触、吸入、吞食微量可中毒死亡 | |
| D. | 电石属于危化品中的遇湿易燃固体,需贴上右图标志,其着火时不能用水灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
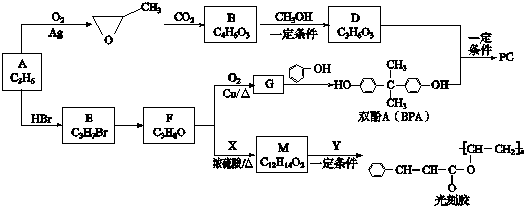
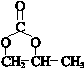 .
. .
.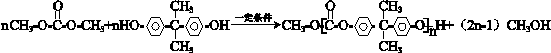 .
.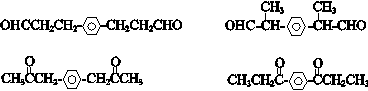 (其中一种).
(其中一种).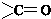 结构
结构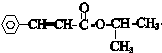 +
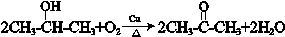
+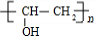 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$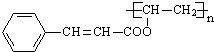 +nCH3CHOHCH3.
+nCH3CHOHCH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
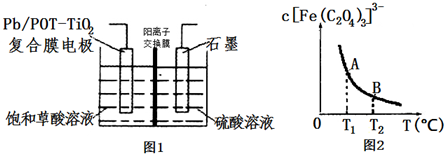
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
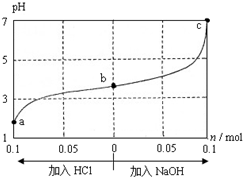
| A. | a、b、c 对应的混合液中,水的电离程度由大到小的顺序的是a>b>c | |
| B. | c点混合液中c(Na+)>c(CH3COO-) | |
| C. | 加入NaOH过程中,$\frac{c(N{a}^{+})×c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$减小 | |
| D. | 若忽略体积变化,则25℃时CH3COOH的电离平衡常数 K=$\frac{0.2}{w-0.2}$×10-7 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
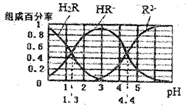
| A. | 在pH=4.4的溶液中:3c(HR-)=c(Na+)+c(H+)-c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2R溶液混合后,溶液中水的电离程度比纯水小 | |
| C. | 在pH=3的溶液中存在 $\frac{c({R}^{2-})×c({H}_{2}R)}{c(H{R}^{-})^{2}}$=10-3.1 | |
| D. | 向Na2CO3溶液中加入少量H2R溶液,发生反应:CO32-+H2R=HCO3-+HR- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32-)>c(HCO3- )>c(OH-) | |
| B. | 20ml 0.1mol/L CH3COONa溶液与10ml0.1mol/L HCl溶液混合后溶液呈酸性,所得溶中:C(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+ )+c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com