
 的电离程度分别用α1、α2表示,则α1小于α2(填“大于”、“小于”、“等于”或“无法确定”)
的电离程度分别用α1、α2表示,则α1小于α2(填“大于”、“小于”、“等于”或“无法确定”) 分析 (1)水的电离是吸热过程,降低温度抑制水电离,导致水中c(H+)、c(OH-)都减小;设出两溶液的体积,然后根据溶液pH计算出氢氧化钠溶液中氢氧根离子浓度、硫酸溶液中氢离子浓度,然后计算出二者体积之比;
(2)95℃时,水的离子积为10-6×10-6=10-12,pH1=a的某强酸溶液中c(H+)=10-a mol/L,pH2=b的某强碱溶液c(OH-)=10b-12mol/L,溶液呈中性,则酸中氢离子的物质的量应等于碱中氢氧根离子的物质的量;
(3)酸和碱溶液抑制了水的电离,则酸中氢离子、碱中氢氧根离子浓度越大,水的电离程度越小.
解答 解:(1)水的电离是吸热过程,升高温度,使水的电离程度增大,当温度升高时,促进水的电离,水的离子积增大,水中氢离子、氢氧根离子浓度都增大,水的pH减小,但溶液仍然呈中性;
25℃时,将pH=9的NaOH溶液中C(OH-)=10-5mol/L,pH=4的H2SO4溶液中c(H+)=10-4mol/L,要使混合溶液呈中性,则氢氧根离子的物质的量等于氢离子的物质的量,设碱的体积为xL,酸的体积为yL,则10-5 mol/L×xL=10-4 mol/L×yL,所以x:y=10-4:10-5=10:1,
故答案为:A,水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小;10:1;
(2)95℃时,水的离子积为10-6×10-6=10-12,pH1=a的某强酸溶液中c(H+)=10-a mol/L,pH2=b的某强碱溶液c(OH-)=10b-12mol/L,溶液呈中性,则酸中氢离子的物质的量应等于碱中氢氧根离子的物质的量,所以100×10-a=1×10b-12,整理可得:a+b=14,
故答案为:a+b=14;
(3)在曲线A中,水的离子积为10-7×10-7=10-14,pH=2的HCl中c(H+)=10-2mol/L,pH=11的某BOH溶液中c(OH-)=10-3mol/L,因c(H+)>c(OH-),故在盐酸中水的电离受到的抑制作用比较大,即:α1小于α2,
故答案为:小于.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确酸碱混合的定性判断方法及溶液酸碱性与溶液pH的关系为解答关键,试题侧重考查学生的分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
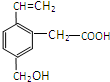 某有机物的结构如图所示,这种有机物不可能具有的性质是
某有机物的结构如图所示,这种有机物不可能具有的性质是| A. | ①④ | B. | 只有⑥ | C. | 只有③ | D. | ④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Na2O2固体中含有的阴离子数为2NA | |
| B. | 常温常压下,3.2g CH4中含有的电子数为2NA | |
| C. | 标准状况下,11.2L乙酸乙酯中含有的分子数为0.5NA | |
| D. | 100mL 1mol•L-1 CH3COOH溶液中含有的CH3COOH分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 0-6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L•min) | |
| B. | 6-10min的平均反应速率:v(H2O2)<3.3×10-2mol/(L•min) | |
| C. | 反应到6min时,H2O2分解了50% | |
| D. | 反应到6min时,c(H2O2)=0.30mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L的水所含有的分子数是NA | |
| B. | 常温常压下,11.2L CO2的中所含O原子数为NA | |
| C. | 32g氧气在标准状况下所占的体积与相同条件下NA个N2分子所占的体积相同 | |
| D. | 标准状况下,11.2L NO、NO2混合气体含有的氮原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 标准状况下,2.24L乙烷中含有的极性键数目为0.6NA | |
| C. | 室温下,3g甲醛和乙酸的混合物中含有的原子数目为0.8NA | |
| D. | 56g铁与足量稀硫酸反应转移的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.6g重水中含有的中子数为2NA | |
| B. | 16.0g的过氧(根)离子中含有的电子数为9NA | |
| C. | 100mL 3.0mol/L的盐酸与5.6g铁屑完全反应转移的电子数为0.3NA | |
| D. | 含2mol H2SO4的浓硫酸与足量金属铜完全反应,产生SO2分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na218O中氧离子的结构示意图: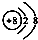 | |
| B. | 比例模型 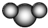 ,表示二氧化碳或水分子 ,表示二氧化碳或水分子 | |
| C. | 碳正离子 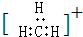 中质子数与电子数之比值为3:2 中质子数与电子数之比值为3:2 | |
| D. | TNT 结构简式: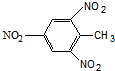 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com