
| A. | Na+、K+、Cl-、NO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、Ag+、NO3-、HCO3- | D. | Na+、NH4+、CO32-、OH- |
分析 在碳酸钙中加入适量盐酸至二者恰好完全反应,得到溶液M,M溶液中含有氯化钙,无色时可排除Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.四种离子之间不反应,都不与氯化钙反应,都是无色离子;
B.铜离子为有色离子;
C.银离子与碳酸氢根离子发生双水解反应;
D.铵根离子与氢氧根离子反应,碳酸根离子与钙离子反应生成碳酸钙沉淀.
解答 解:在碳酸钙中加入适量盐酸至二者恰好完全反应,得到溶液M,M溶液中含有氯化钙,无色时可排除Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.Na+、K+、Cl-、NO3-之间不反应,都是无色离子,都不与氯化钙反应,在溶液中能够大量共存,故A正确;
B.Cu2+为有色离子,不满足溶液无色的条件,故B错误;
C.Ag+、HCO3-之间发生双水解反应,在溶液中不能大量共存,故C错误;
D.NH4+、OH-之间反应生成一水合氨按,CO32-与钙离子反应,在原子不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


 综合自测系列答案
综合自测系列答案科目:高中化学 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:填空题
Ⅰ.反应:aA(g) + bB(g)  cC(g) △H<0 在2L恒容容器中进行。改变其他反应条件,在第一、第二和第三阶段体系中各物质的物质的量随时间变化的曲线如图所示:
cC(g) △H<0 在2L恒容容器中进行。改变其他反应条件,在第一、第二和第三阶段体系中各物质的物质的量随时间变化的曲线如图所示:
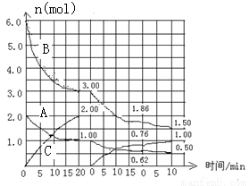
回答问题:
(1)反应的化学方程式中,a:b:c == 。
(2)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 。
(3)比较第二阶段反应温度(T2)和第三阶段反应温度(T3)的高低:T2 T3(填“>”“<”或“=”),判断的理由是 。
(4)第三阶段平衡常数K3的计算式 。
Ⅱ.利用图①中的信息,按图②装置链接的A、B瓶中已充有NO2气体。
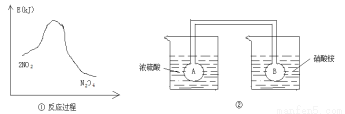
(5)B瓶中的气体颜色比A瓶中的 (填“深”或“浅”),其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 | |
| B. | 原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子 | |
| C. | 2p轨道上有一个空轨道的X原子与3p轨道上有一个空轨道的Y原子 | |
| D. | 最外层都只有一个电子的X、Y原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡体系中C的体积分数为$\frac{1}{9}$ | B. | 平衡时A的浓度为2.4mol/L | ||
| C. | D的平均速率为0.32mol/L•min | D. | B的转化率为20% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
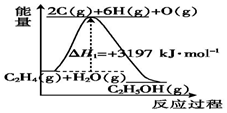 乙醇用途广泛,常用作溶剂、饮料、燃料等.
乙醇用途广泛,常用作溶剂、饮料、燃料等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| A | 基态原子的价电子排布式为nSnnPn |
| B | 基态原子中的未成对电子数是同周期中最多的 |
| C | 最外层电子数是电子层数的3倍 |
| D | 简单离子是第三周期元素中离子半径最小的 |
| E | 价电子层中的未成对电子数为4 |
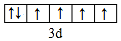 .
.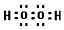 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH相同的盐酸与氯化铵溶液中,水的电离程度相同 | |
| B. | 溶液加水稀释时,$\frac{c(N{H}_{3}{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$逐渐增大 | |
| C. | 加入少量Mg(OH)2固体,c(NH4+)减小 | |
| D. | 加入等体积0.05mol﹒L-1NaOH溶液时:c(Na+)=c(CI-)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水溶液中能电离出H+的化合物叫做酸 | |
| B. | 实验测得2mol某气体体积为44.8L,则测定条件一定是标准状况 | |
| C. | 摩尔是七个基本物理量之一 | |
| D. | 化合物分为酸、碱、盐和氧化物是用树状分类法分类的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯使溴水褪色的原因不同 | |
| B. | 苯和氢气在一定条件下生成环己烷的反应为还原反应 | |
| C. | 硝基苯和乙酸乙酯的制备都发生了取代反应 | |
| D. | 由乙醇制取乙烯发生了氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com