
重金属离子具有毒性。实验室中有甲、乙两种重金属离子的废液,甲废液经化验呈碱性,主要为有毒离子为Ba2+,如将甲、乙两废液按一定比例混合,毒性明显降低。则乙废液中可能含有的离子是( )
A. Cu2+和SO42- B. Cu2+和Cl C. K+和SO42- D. Ag+和NO3
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X(g) + 2Y(g)  2Z(g),达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3 : 2,则Y的转化率最接近于
2Z(g),达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3 : 2,则Y的转化率最接近于
A.33% B.40% C.50% D.67%
查看答案和解析>>
科目:高中化学 来源: 题型:
用实验确定某酸HA是弱电解质。两同学的方案是:
甲:① 称取一定质量的HA配制0.lmol/L的溶液100mL;
② 用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙:①取相同体积、相同物质的量浓度的HA溶液、盐酸装入两个试管,
②同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在甲方案的第①步中,要用到的定量仪器是
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填>、<、=),乙方案中,说明HA是弱电解质的现象是 (多选扣分)
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式中,正确的是( )
A、 稀硫酸与氢氧化钡反应:Ba2++ SO42- = BaSO4↓
B、 铁和稀盐酸:2Fe+6H+=2Fe3++3H2↑
C、 氢氧化铜溶于稀硫酸 :Cu(OH)2+2H+=2H2O+Cu2+
D、 盐酸与石灰石溶液反应:CO32-+2H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
现有m g某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol;
(2)该气体所含原子总数为_______ _个;。
(3)该气体在标准状况下的体积为____________L;
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为_____________,
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为_________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实中不能应用勒夏特列原理来解释的是
A、新制的氯水在光照条件下颜色变浅
B、加入催化剂能使合成氨的速率加快
C、高压对合成氨有利
D、室温比500℃左右更有利于合成氨的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列体系的熵变大于零的是
A.水蒸气冷凝成水 B.乙烯聚合成聚乙烯
C.2NO2(g) N2O4(g) D.CaCO3(s) CaO(s)+CO2(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度和压强下,有如下反应:
2SO2(g)+O2(g)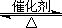 2SO3(g),将1.6molSO2和0.8mol的O2放入一体积可变的密闭容器中,测得容器的起始容积为100L。经一段时间后,反应达到平衡,测得混合气体的体积为80L。请回答下列问题:
2SO3(g),将1.6molSO2和0.8mol的O2放入一体积可变的密闭容器中,测得容器的起始容积为100L。经一段时间后,反应达到平衡,测得混合气体的体积为80L。请回答下列问题:
⑴达平衡时SO2的转化率为 ;
⑵若起始时加入amolSO2、bmolO2,且a︰b=2︰1,在同样温度和压强下,反应达到平衡时,测得混合气体的容积为120L。则a、b的值分别为:a= ,b= ;
⑶若容器为体积不变的密闭容器,其容积为100L。起始时加入xmolSO2、ymolO2和zmolSO3,反应达平衡时,温度和压强与(2)完全相同,容器内各气体的体积分数也与(2)达平衡时的情况完全相同。则x、y应该满足的关系式为 ,x、z应该满足的关系式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com