
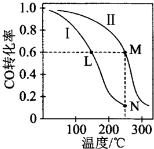
| A. | 该反应的△H>0 | |
| B. | N点化学平衡常数K=0.59 | |
| C. | L、M两点容器内压强:P(M)>2P(L) | |
| D. | 向N点平衡体系中再加入1 mol CH3OH,建立新平衡时被分解的CH3OH物质的量小于0.4 mol |
分析 A.CO转化率随温度升高减小,说明升温平衡逆向进行逆反应为吸热反应,正反应为放热反应;
B.依据化学平衡三行计算列式计算M点平衡浓度,计算平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)c({H}_{2})^{2}}$,M、N点化学平衡常数相同;
C.L、M两点是不同温度下的平衡,压强和气体物质的量成正比,结合转化率计算平衡状态下气体物质的量比较;
D.N点平衡体系中再加入1 mol CH3OH,相当于再加入1molmol CO和2 mol H2,最后达到平衡状态和向Ⅱ中加入2 mol CO和4 mol H2的平衡状态相同,据此计算.
解答 解:A.图象分析可知,CO(g)+2H2(g)?CH3OH(g),反应中CO转化率随温度升高减小,说明升温平衡逆向进行,逆反应为吸热反应,正反应为放热反应,△H<0,故A错误;
B.依据化学平衡三行计算列式计算M点平衡浓度,CO转化率为60%,
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) 2 4 0
变化量(mol/L) 1.2 2.4 1.2
平衡量(mol/L) 0.8 1.6 1.2
计算平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)c({H}_{2})^{2}}$=$\frac{\frac{1.2}{2}}{\frac{0.8}{2}×(\frac{1.6}{2})^{2}}$=0.59,平衡常数随温度变化,M、N点温度相同化学平衡常数相同,故B正确;
C.L、M两点是不同温度下的平衡,压强和气体物质的量成正比,CO转化率为60%,
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 1 2 0
变化量(mol) 0.6 1.2 0.6
平衡量(mol) 0.4 0.8 0.6
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 2 4 0
变化量(mol) 1.2 2.4 1.2
平衡量(mol) 0.8 1.6 1.2
所以L、M两点容器内压强之比等于气体物质的量之比=(0.4+0.8+0.6):( 0.8+1.6+1.2)=1.8:3.6=1:2
P(M)=2P(L),但温度升高,M点压强增大,P(M)>2P(L),故C正确;
D.N点平衡体系中再加入1 mol CH3OH,相当于Ⅰ中再加入1molmol CO和2 mol H2,最后达到平衡状态和向Ⅱ中加入2 mol CO和4 mol H2的平衡状态相同,甲醇最后平衡状态为1.2mol,CO转化率60%,则相当于逆向进行甲醇分解率为40%,加入1mol甲醇增大压强平衡正向进行,则分解率小于40%,分解的甲醇小于0.4 mol,故D正确;
故选BCD.
点评 本题考查了化学平衡影响因素、平衡常数的计算,注意图象的理解应用,平衡常数随温度变化,不随浓度变化,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | CH2═CH-CH2CH2CH2CH3 | B. | CH3CH2CH═CHCH2CH3 | ||
| C. | CH3CH═CHCH2CH2CH3 | D. | 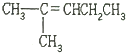 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物 | |
| B. | HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 | |
| C. | 漂白粉、福尔马林、冰水、王水、氯水均为混合物 | |
| D. | Na2O,NaOH,NaCl,Na2SO4,Na2O2都属于钠的含氧化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制标准溶液的NaOH中混有Na2CO3杂质 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其他操作正确 | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗 | |
| D. | 滴定过程中不小心将液体从锥形瓶溅出 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ①、② | B. | ①、③ | C. | ②、③ | D. | ①、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2:1 | B. | 1:2:3 | C. | 1:3:2 | D. | 3:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、NO3-、Cl-、K+ | B. | Na+、Fe2+、Cl-、NO3- | ||
| C. | K+、Ba2+、OH-、SO42- | D. | Cu2+、NH4+、Br-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com