
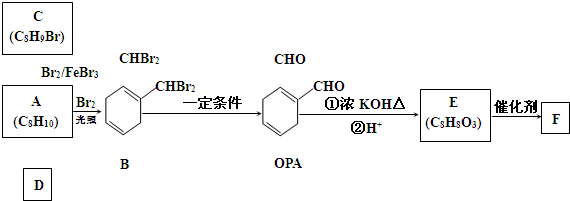

| 浓硫酸 |
| 170℃ |
| Br2 |

 ,B发生一系列反应后生成邻苯二甲醛,结合已知条件知,邻苯二甲醛反应生成E,E的结构简式为
,B发生一系列反应后生成邻苯二甲醛,结合已知条件知,邻苯二甲醛反应生成E,E的结构简式为 ,E发生缩聚反应生成F,F的结构简式为
,E发生缩聚反应生成F,F的结构简式为 ,结合物质的性质来分析解答.
,结合物质的性质来分析解答. ,B发生一系列反应后生成邻苯二甲醛,结合已知条件知,邻苯二甲醛反应生成E,E的结构简式为
,B发生一系列反应后生成邻苯二甲醛,结合已知条件知,邻苯二甲醛反应生成E,E的结构简式为 ,E发生缩聚反应生成F,F的结构简式为
,E发生缩聚反应生成F,F的结构简式为 ,
, ,其名称是邻二甲苯,故答案为:邻二甲苯;
,其名称是邻二甲苯,故答案为:邻二甲苯;  ,
, ;
;  ,
, ;
; ,
, ;
; ,E发生缩聚反应生成F,该反应方程式为:
,E发生缩聚反应生成F,该反应方程式为: ,
, ;
; ,芳香化合物G是E的同分异构体,G分子中含有醛基、酯基和醚基三种含氧官能团,则G的结构简式可能为:
,芳香化合物G是E的同分异构体,G分子中含有醛基、酯基和醚基三种含氧官能团,则G的结构简式可能为: ,共4种,其中核磁共振氢谱中峰面积比3:2:2:1的化合物的结构简式为
,共4种,其中核磁共振氢谱中峰面积比3:2:2:1的化合物的结构简式为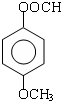 ,
, .
.


 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
 CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.已知:CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):如图请回答下列问题:
CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.已知:CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):如图请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应的氧化剂为KMnO4 |
| B、发生还原反应的是H2C2O4 |
| C、该离子方程式右侧方框内的产生是H2O |
| D、6molH+参加反应时,电子转移10mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓度 时间/min 物质 | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol?L-1 | 0.13mol?L-1 | 0.1mol?L-1 | 0.1mol?L-1 | 0.09moˉL-1 |
| H2 | 0mol?L-1 | 0.2mol?L-1 | 0.3mol?L-1 | 0.3mol?L-1 | 0.33mol?L-1 |
| n(CH4) |
| n(H2O) |

查看答案和解析>>
科目:高中化学 来源: 题型:
 各种污染日趋严重,防止污染、改善水质的主要措施是对废气,废水进行处理.
各种污染日趋严重,防止污染、改善水质的主要措施是对废气,废水进行处理.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com