
 ①某烷烃分子式为C6H14,若该烷烃可由两种炔烃与氢气加成得到,则该烷烃的结构简式为(CH3)2CHCH2CH2CH3.
①某烷烃分子式为C6H14,若该烷烃可由两种炔烃与氢气加成得到,则该烷烃的结构简式为(CH3)2CHCH2CH2CH3.分析 ①某烷烃分子式为C6H14,若该烷烃可由两种炔烃与氢气加成得到,说明烃中3个C至少含2个H;
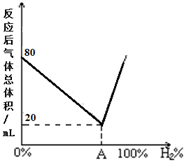
②不饱和烃与氢气恰好反应时,反应后混合气体的总体积最小,由图可知,反应后混合气体体积最小,为20mL,即反应后CnHm+x的体积,反应前CmHn的体积也为20mL,则反应前H2的体积为80mL-20mL=60mL,然后求出体积分数;相同条件下,气体体积之比等于物质的量之比,根据原子守恒确定x的值;
解答 解:①某烷烃分子式为C6H14,若该烷烃可由两种炔烃与氢气加成得到,说明烃中3个C至少含2个H,符合条件的结构简式为(CH3)2CHCH2CH2CH3;
故答案为:(CH3)2CHCH2CH2CH3;
不饱和烃与氢气恰好反应时,反应后混合气体的总体积最小,由图可知,反应后混合气体体积最小,为20mL,即反应后CnHm+x的体积,反应前CmHn的体积也为20mL,则反应前H2的体积为80mL-20mL=60mL,A点氢气的体积分数等于$\frac{60mL}{80mL}$×100%=75%,故CmHn、H2、CmHn+x的物质的量之比=20mL:60mL:20mL=1:3:1,则反应为:CmHn+3H2$\stackrel{一定条件}{→}$CmHn+x,根据H原子守恒,则x=6;
故答案为:75%;6;
点评 本题考查了加成反应原理、化学方程式的有关计算,明确不饱和烃与氢气恰好反应时反应后混合气体的总体积最小是解题的关键,难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 节日燃放的烟花,就是碱金属以及锶、钡等金属化合物焰色反应所呈现的色彩 | |
| B. | 铝制饭盒不宜长时间存放酸性或碱性的食物 | |
| C. | 可以用ClO2、O2代替Cl2对自来水进行消毒 | |
| D. | 玛瑙饰物的主要成分与制造计算机芯片的主要成分相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ]2-,CO2的结构式为O=C=O.与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为3s23p1,其中能量最高的电子有1个.
]2-,CO2的结构式为O=C=O.与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为3s23p1,其中能量最高的电子有1个.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
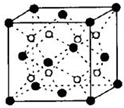 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p轨道有3个未成对电子;C的基态原子2p轨道有1个未成对电子;E原子最外层有1个未成对电子,其次外层有3种原子轨道且均排满电子,;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p轨道有3个未成对电子;C的基态原子2p轨道有1个未成对电子;E原子最外层有1个未成对电子,其次外层有3种原子轨道且均排满电子,;D与E同周期,价电子数为2.则:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
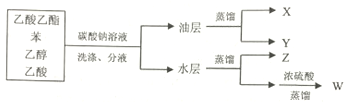
| A. | X是最简单的芳香烃,分子中含有三个碳碳双键 | |
| B. | Y是具有芳香气味的液体,难溶于水,易溶于有机溶剂,能发生水解反应 | |
| C. | Z是无色,有特殊香味的液体,与硫酸混合在140℃可以制备乙烯 | |
| D. | W是有强烈刺激性气味的无色液体,可与氢气发生加成反应,生成Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
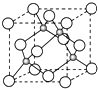 A、B、C是短周期非金属元素,核电荷数依次增大.A元素原子核外有三种不同的能级且各个能级所填充的电子数相同,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:
A、B、C是短周期非金属元素,核电荷数依次增大.A元素原子核外有三种不同的能级且各个能级所填充的电子数相同,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com