
【题目】在盛有1L0.1mol/LCuSO4溶液的大烧杯中,用锌、铜作电极,用导线连接形成原电池,当电极锌消耗3.25g时,试完成:
(1)写出电极反应式:负极__________________;正极____________。
(2)电极上析出铜的质量。__________________
【答案】Zn-2e-=Zn2+ Cu2++2e-=Cu 3.2g
【解析】
(1)用锌、铜作电极,锌较活泼,为原电池的负极,发生氧化反应,正极铜离子发生还原反应;
(2)结合物质的物质的量以及电极方程式计算。
(1)用锌、铜作电极,锌较活泼,为原电池的负极,发生氧化反应,电极方程式为Zn-2e-=Zn2+,正极发生还原反应,电极方程式为:Cu2++2e-=Cu,
故答案为:Zn-2e-=Zn2+;Cu2++2e-=Cu;
(2)n(Zn)=![]() =0.05mol,
=0.05mol,
负极发生Zn-2e-=Zn2+,可失去0.1mol电子,正极发生Cu2++2e-=Cu,Cu2+得到0.1mol电子,生成的铜为0.05mol,质量为0.05mol×64g·mol-1=3.2g,故答案为:3.2。


科目:高中化学 来源: 题型:
【题目】对达到化学平衡状态的可逆反应:A+B ![]() C+D,若t0时增大压强,正、逆反应速率变化如图所示(v代表反应速率,t代表时间),下列有关A、B、C、D的状态叙述中正确的是( )
C+D,若t0时增大压强,正、逆反应速率变化如图所示(v代表反应速率,t代表时间),下列有关A、B、C、D的状态叙述中正确的是( )

A.A、B、C是气体,D不是气体
B.A、B是气体,C、D有一种是气体
C.C、D是气体,A、B有一种是气体
D.C、D有一种是气体,A、B都不是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Cl-浓度为0.5 mol·L-1的某无色澄清溶液中,还可能含有下表中的若干种离子。
阳离子 | K+ Ag+ Mg2+ Ba2+ Fe3+ |
阴离子 | NO3- CO32- SiO32- SO42- |
提示:SiO32-+2H+=H2SiO3↓(H2SiO3是白色沉淀)、H2SiO3![]() SiO2+H2O
SiO2+H2O
现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下0.56 L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4 g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题。
(1)通过以上实验能确定一定不存在的阳离子是______,一定不存在的阴离子是________。
(2)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子及其浓度(不一定要填满)
阴离子 | ①___ | ②___ | ||
c/mol·L-1 | ____ | ___ |
(3)判断K+是否存在,若存在求其最小浓度,若不存在说明理由:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漂白粉和漂粉精是常用的消毒清洁用品,有效成分均为Ca(ClO)2,相应的生产流程如下。
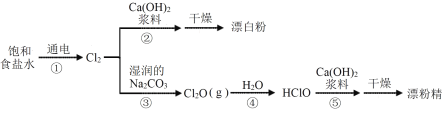
下列说法不正确的是
A.①中阳极的电极反应式为2Cl--2e-=Cl2↑
B.②中反应的化学方程式为2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O
C.上述过程涉及氧化还原反应、化合反应、复分解反应
D.制备漂粉精过程中,Cl2转化为Ca(ClO)2时,Cl的原子利用率为100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某MCFC型燃料电池可同时供应电和水蒸汽,其工作温度为600℃~700℃,所用燃料为氢气,电解质为熔融的K2CO3。该电池的总反应为:2H2+O2=2H2O,负极电极反应式为: H2+CO32——2e—![]() H2O+CO2。则下列判断中正确的是
H2O+CO2。则下列判断中正确的是
A.放电时CO32—向负极移动
B.放电时CO32—向正极移动
C.正极反应: 4OH——4e—=2H2O+O2↑
D.当电池中生成1 mol水时,转移4 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向20mL 0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是
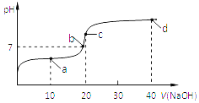
A. a点时:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
B. b点时:c(Na+) = c(CH3COO-)
C. c点时:c(OH-) =c(CH3COOH) + c(H+)
D. d点时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素![]() 是一种重要的化工产品,工业生产尿素的主要流程如下:
是一种重要的化工产品,工业生产尿素的主要流程如下:
![]()
(1)工业合成氨的化学方程式是_______。
(2)尿素分子中C、N原子间的共用电子对偏向N原子,从原子结构的角度解释原因:______。
(3)由NH3和CO2合成尿素分为两步反应(均为可逆反应),其能量变化示意图如下:
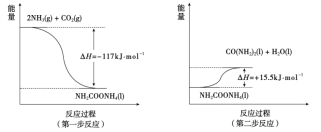
①合成尿素总反应的热化学方程式是_______。
②粗尿素中含有NH2COONH4杂质。通过控制温度和压强,可将NH2COONH4分解为NH3和CO2。研究温度和压强对NH2COONH4分解率的影响,结果如下:
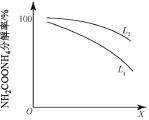
X代表_____(填“温度”或“压强”),L1_____L2(填“>”或“<”)。
(4)工业上含尿素的废水需经处理后才能排放。一种利用电化学方法降解尿素的装置示意图如下:
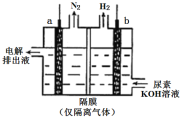
写出尿素被降解的电极反应式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下的一密闭容器中事先放入1.56g过氧化钠,然后再通入乙烷与氧气的混合气体,用电火花引爆,直至反应完全为止,恢复到原温度,容器内压强近似为零。
(1)相同条件下,通入的气体氧气和乙烷的体积比是多少?_____
(2)通入氧气的质量最大应是多少?_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了解决能源的可再生及将CO2变废为宝等问题,科学家借鉴自然界的光合作用原理,通过“人工” 光合作用合成了甲醇等液态燃料,因此甲醇又被称为液态太阳燃料。液态太阳燃料的合成及应用如下图所示。 请回答:
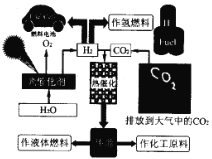
(1) 联系自然界的光合作用原理,并结合上述图示, 写出“人工”光合作用的化学方程式;______;在图示转化过程中,太阳能除了储存在甲醇中,还储存在_____中(填化学式)。
(2)图中热催化过程的反应原理为CO2(g) + 3H2(g) = CH3OH(g) + H2O(g)△H。
已知:2H2(g)+O2(g)=2H2O (g)△H1= -483.6 kJmo1-1;
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H2=-1352.86 kJmol-1
△H =_____________。
(3)实验室对热催化反应进行模拟探究:一定温度下,向容积均为2 L 的恒容密闭容器中分别通入1.0 mol CO2(g)和3.0 mol H2(g), 在不同催化剂X、Y 的催化下发生反应。测得5 min时,CO2转化率与温度的变化关系如图所示。
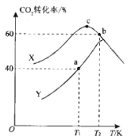
①该反应适宜选用的催化剂为__________(填“X'”或 “Y”)。
②T1K时,a点对应容器在0~5 min内的平均反应速率v(H2)=______;b、c点对应状态下反应物的有效碰撞几率b______c(填“>”“<”或“=”),原因为___________。
③T2K时,若反应前容器内的压强为p, 则该温度下反应的平衡常数KP=_________。 (KP为用分压表示的平衡常数)。
(4)我国化学家结合实验和计算机模拟结果,研究得出热催化反应的一种可能历程如图所示,其中自由基用“”标出,过渡态用TS表示。
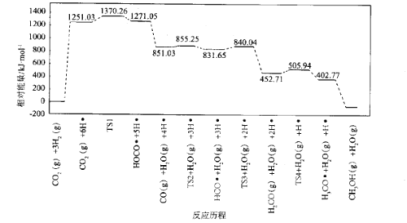
四个过渡态中对反应速率影响最大的是____,理由为____;该步骤的化学方程式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com