
| A. | 乙烯和酸性高锰酸钾溶液的反应 | |
| B. | 在一定条件下,乙烯和水的反应 | |
| C. | 在FeBr3催化作用下,苯和溴的反应 | |
| D. | 在镍作催化剂、加热的条件下,苯和氢气的反应 |
科目:高中化学 来源: 题型:填空题
 20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是H2O和CO反应生成CO2和H2过程中的能量变化示意图.由图可知,CO2和H2的总能量小于(填“大于”、“小于”或“等于”)H2O和CO的总能量,则该反应是放热(填“吸热”或“放热”)反应.
20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是H2O和CO反应生成CO2和H2过程中的能量变化示意图.由图可知,CO2和H2的总能量小于(填“大于”、“小于”或“等于”)H2O和CO的总能量,则该反应是放热(填“吸热”或“放热”)反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸 小苏打 硫酸钾 | B. | 硅酸 熟石灰 生石灰 | ||
| C. | 硫酸 烧碱 硫酸铝 | D. | 盐酸 纯碱 食盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
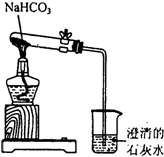 某实验小组的同学为探究碳酸钠、碳酸氢钠的性质,进行了如下实验.请按要求回答下列问题.
某实验小组的同学为探究碳酸钠、碳酸氢钠的性质,进行了如下实验.请按要求回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若图Ⅰ所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好 | |
| B. | 用图2装置可测定过氧化氢分解反应产生气体体积(液体体积忽略) | |
| C. | 用图3装置制备金属锰 | |
| D. | 用图4装置可验证化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
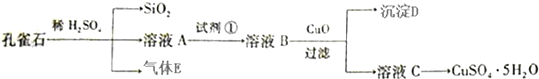
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com