
【题目】烯烃是重要的有机化工原料。实验室主要用浓硫酸或浓磷酸作催化剂使醇脱水制取烯烃。某同学使用环己醇脱水制备环己烯。设计方案如下:
(一)主要仪器和试剂
仪器:50mL圆底烧瓶、分馏柱、直形冷凝管、10mL量筒、分液漏斗、100mL锥形瓶、蒸馏头、接液管。
试剂:10.0g(10.4mL,0.1mol)环己醇、5mL浓磷酸、氯化钠、无水氯化钙、5%碳酸钠水溶液。
(二)查阅实验所涉及的反应物、催化剂、产物的各种物理性质,列表如下:
化学物质 | 相对分子 质量 | 相对密度/ g·cm-3 | 沸点/℃ | 溶解性 |
环己醇 | 100 | 0.96 | 161.1 | 稍溶于水 |
磷酸(85%) | 98 | 1.83 | 213 | 易溶于水 |
环己烯 | 82 | 0.89 | 83.3 | 微溶于水 |
(三)实验流程


请回答:
(1)加热过程中,若忘记加沸石,应如何操作?___
(2)将粗产品分去水层所需要用到的主要实验仪器是___。
(3)本实验用浓磷酸代替浓硫酸的优点:___。
(4)该实验的主要副产物为___(填物质名称)。
(5)在提纯环己烯时,用等体积的饱和食盐水,而不用水的原因是___。加入3~4mL5%碳酸钠溶液的目的是___。
(6)水浴蒸馏最后得到7.0g产品,则反应的产率为___(保留2位有效数字)。
【答案】先停止加热,待反应液冷却后再加入沸石 分液漏斗 浓磷酸氧化性比浓硫酸弱,防止浓硫酸氧化有机物 环己醚 降低环己烯在水中的溶解度,减少产品损失 除去产品中少量的磷酸 85%
【解析】
⑴加热过程中,若忘记加沸石,应先停止加热,待反应液冷却后再加入沸石。
⑵由实验流程以及表格中环己醇、浓磷酸、环己烯的溶解性可知,应该用分液漏斗将粗产品分去水层。
⑶浓硫酸的氧化性强,易氧化有机物,因此用浓磷酸代替。
⑷醇可能发生消去反应生成环己烯,也可能发生分子间取代反应,生成环己醚。
⑸因环己烯微溶于水,洗涤时用饱和食盐水可降低环己烯在水中的溶解度,产品中还有残留的磷酸,用5%碳酸钠溶液是为了除去产品中少量的磷酸。
⑹根据关系计算理论产量,再根据实际与理论计算产率。
⑴加热过程中,若忘记加沸石,应先停止加热,待反应液冷却后再加入沸石,故答案为:先停止加热,待反应液冷却后再加入沸石。
⑵由实验流程以及表格中环己醇、浓磷酸、环己烯的溶解性可知,将粗产品分去水层的实验操作为分液,因此所需要用到的主要实验仪器是分液漏斗,故答案为:分液漏斗。
⑶浓硫酸的氧化性强,加热时易氧化有机物,而浓磷酸的氧化性比浓硫酸弱,故使用浓磷酸更好,故答案为:浓磷酸氧化性比浓硫酸弱,防止浓硫酸氧化有机物。
⑷醇在浓磷酸的催化作用下发生消去反应生成环己烯,但同时也可能发生分子间取代反应,生成环己醚,故答案为:环己醚。
⑸因环己烯微溶于水,故洗涤时用饱和食盐水可降低环己烯在水中的溶解度,减少产品损失;因产品中还有残留的磷酸,加入5%碳酸钠溶液是为了除去产品中少量的磷酸;故答案为:降低环己烯在水中的溶解度,减少产品损失;除去产品中少量的磷酸。
⑹加入的环己醇为10.0g,根据以下关系式
环己醇~环己烯
100g 82g
10.0g x
![]() ,解得x = 8.2g,理论上应生成的环己烯为8.2g,反应的产率为
,解得x = 8.2g,理论上应生成的环己烯为8.2g,反应的产率为![]() ×100%≈85%,故答案为:85%。
×100%≈85%,故答案为:85%。


科目:高中化学 来源: 题型:
【题目】元素C与过渡元素Co、Fe、Ni等在工业、农业、科学技术以及人类生活有机合成等方面有重要作用。
(1)基态Co原子价电子轨道排布图为______,第四电离能I4(Co)<I4(Fe),其原因是______。
(2)(CH3)3C+是有机合成重要中间体,该中间体中碳原子杂化方式为______。
(3)Co2+在水溶液中以[Co(H2O)6]2+存在。向含Co2+的溶液中加入过量氨水可生成更稳定的[Co(NH3)6]2+,其原因是______。
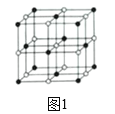
(4)Co的一种氧化物的晶胞如图1。己知钴原子的半径为apm,氧原子的半径为bpm,它们在晶体中是紧密接触的,在该钴的氧化物晶胞中原子的空间利用率为______(列出含a、b的计算表达式即可)(提示:条件不足,无法判断钴原子之间是否紧密接触)。
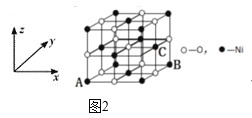
(5)NiO的晶体结构如图2所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.lmol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是__________。
(2)甲组同学取2 mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是__________。
(4)丙组同学取5mL0.1mol·L-1KI溶液,加入3mL0.1mol·L-1FeCl3溶液混合,分别取2mL此混合溶液于2支试管中进行如下实验:
①第一支试管中加入1 mLCCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴KSCN溶液,溶液变红。
实验②说明:在![]() 过量的情况下,溶液中仍含有________(填离子符号)。
过量的情况下,溶液中仍含有________(填离子符号)。
(5)丁组同学向盛有少量H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,1LC2H5OH完全燃烧后生成的CO2分子个数约为![]()
B.20gD2O与20gH218O含有的中子数均为10NA
C.1mol·L-1Al(NO3)3溶液中含有3NA个NO3-
D.50mL12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二水合草酸亚铁(FeC2O42H2O)是制备某种铁锂电池最常用的原料。国内某科研团队以氮气为保护气,对二水合草酸亚铁的受热分解情况进行研究,生成的气体只含CO、CO2和H2O(g),得到固体质量与加热温度的变化曲线如图所示。下列说法正确的是
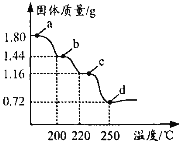
A.b点的固体成份为FeC2O4H2O
B.b→c 的方程式为 FeC2O4![]() FeCO3+CO↑
FeCO3+CO↑
C.从a→d, 生成的CO、CO2的物质的量相等
D.加热至250℃以上,固体质量略有增加,可能是因为FeO与CO反应生成了 Fe3C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pK=-lgK,25℃时,二元酸H2A的pK1=1.85,pK2=7.19。25℃时,用0.1mol/LNaOH溶液滴定20mL0.1mol/LH2A溶液的滴定曲线如图所示。下列说法正确的是

A. a点所得溶液中:Vo=10mL
B. C点所得溶液中:c(A2-)=c(HA-)
C. b点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
D. d点所得溶液中:A2-的水解平衡常数K1=1×10-7.19
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G、W、X、Y、Z均为含氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转化关系(未配平):
①G![]() W+NaCl ②W+H2O
W+NaCl ②W+H2O![]() X+H2 ③Y+NaOH
X+H2 ③Y+NaOH![]() G+W+H2O ④Z+NaOH
G+W+H2O ④Z+NaOH![]() W+X+H2O这五种化合物中的氯的化合价由低到高的顺序是( )
W+X+H2O这五种化合物中的氯的化合价由低到高的顺序是( )
A.W、G、Z、Y、XB.G、Y、W、Z、X
C.G、Y、Z、W、XD.Z、X、G、Y、W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 代表阿伏加德罗常数的值,下列叙述正确的是( )
代表阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,![]() 三氧化硫中所含分子数约为
三氧化硫中所含分子数约为![]()
B.![]() 溶液中含有的钾离子数目为
溶液中含有的钾离子数目为![]()
C.![]() 盐酸与足量
盐酸与足量![]() 共热,转移的电子数为
共热,转移的电子数为![]()
D.常温下,![]() 固体
固体![]() 中,含有的阴阳离子总数为
中,含有的阴阳离子总数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
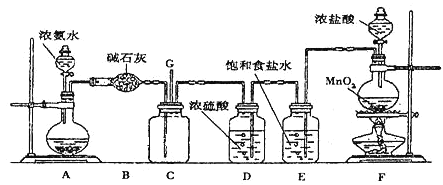
请回答下列问题:
(1)实验室制取氨气的化学方程式为_________;
(2)装置A中的烧瓶内固体不可以选用________(选填序)
A.生石灰 B.碱石灰 C.五氧化二磷 D.烧碱
(3)装置F中发生反应的离子方程式是_________;
(4)B装置的作用_________;E装置的作用_________;
(5)若装置C内出现浓厚的白烟并在容器内壁凝结,且另一生成物是空气的主要成分之一。请写出反应的化学方程式:_________;
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,可以将尾气通入盛有_________溶液的烧杯来处理。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com