
分析 (1)利用盖斯定律可以根据已知的反应的热化学方程式求反应2CO+SO2=S+2CO2的焓变,进而写热化学方程式;
(2)根据所给反应的平衡常数,利用三段式法计算出平衡浓度减小求算,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始浓度(mol/L)0.30 0.30 0 0
转化浓度(mol/L) x x x x
转化浓度(mol/L)0.30-x 0.30-x x x
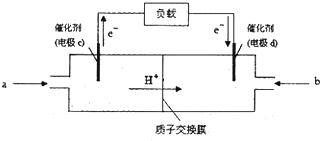
(3)原电池中电子从负极经外电路流向正极,负极反应氧化反应,结合电解质书写电极反应式;
根据c为负极,d为正极,粗铜精炼时,粗铜作阳极,与电源的正极相连;
根据电子得失守恒以及精铜中铜离子得到电子来计算.
解答 解:(1)①2CO(g)+O2(s)=2CO2(g)△H1=-566.0kJ•mol-1
②S(s)+O2(g)=SO2 (g)△H2=-296.0kJ•mol-1
根据盖斯定律,①-②得到2CO(g)+SO2(g)=S(s)+2CO2(g);△H=-270 kJ•mol-1;
故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g)△H3=-270 kJ•mol-1;
(2)设参加反应的CO的浓度为x
CO(g)+H2O(g)?CO2(g)+H2(g)
起始浓度(mol/L)0.30 0.30 0 0
转化浓度(mol/L) x x x x
转化浓度(mol/L)0.30-x 0.30-x x x
K=9.0=$\frac{{x}^{2}}{(0.30-x)^{2}}$,x=0.225,
所以CO的转化率α(CO)=$\frac{0.225mol/L}{0.30mol/L}$×100%=75%,
氢气反应速率v(H2)=$\frac{0.225mol/L}{5min}$=0.045mol/(L•min),
故答案为:75%;0.045mol/(L•min);
(3)甲醇具有还原性,在负极上发生氧化反应生成CO2,电极反应式为:CH3OH-6e-+H2O=CO2+6H+,
因c为负极,d为正极,粗铜精炼时,粗铜作阳极,与电源的正极d相连,
精铜电极电极反应式:Cu2++2e-=Cu,Cu2+的物质的量为=$\frac{64g}{64g/mol}$=1mol,由电子得失守恒可知电子转移2mol,
原电池中正极电极反应为4OH--4e-=2H2O+O2↑,则生成氧气物质的量为0.5mol,体积=0.5mol×22.4L/mol=11.2L;
故答案为:负极;CH3OH-6e-+H2O=CO2+6H+;d;11.2.
点评 本题考查了化学平衡常数的求算、电解质原理、原电池原理、氧化还原反应,综合性强,难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入盐酸以除去硫酸钠中少量的碳酸钠杂质 | |
| B. | 用玻璃棒搅拌漏斗中的液体以加快反应速率 | |
| C. | 用稀硫酸和锌反应制氢气时加入少许硫酸铜以加快反应速率 | |
| D. | 在容量瓶中加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,3.4gH2O2含有极性键的数目为0.2NA | |
| B. | 1molCl2和足量氢氧化钠溶液充分反应,转移电子数目为2NA | |
| C. | 电解精炼铜时,若转移了NA个电子,则阳极质量减小32g | |
| D. | 标况下,11.2LSO3所含的分子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量时,将NaOH固体放在左盘内的纸上,称得质量为10.2 g | |
| B. | 用25 mL碱式滴定管量取高锰酸钾溶液,体积为16.60 mL | |
| C. | 用广泛pH试纸测稀盐酸的pH=3.2 | |
| D. | 用10 mL量筒量取NaCl溶液,体积为9.2 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13.8gNO2与足量水反应,转移电子敬目为0.2NA | |
| B. | 标准状况下,22.4L溴苯中含有氢原子数目为5NA | |
| C. | 500mL2mol/LNH4NO3溶液中,含有NH4+数目为NA | |
| D. | 用惰性电极电解足量CuSO4溶液,生成22.4L气体时转移电子数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态HCl不导电,所以HCl不是电解质 | |
| B. | NH3溶于水形成的溶液能导电,所以NH3是电解质 | |
| C. | Cl2溶于水能导电,所以Cl2是电解质 | |
| D. | BaSO4在水溶液中难导电,但熔融下能导电所以BaSO4是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓、稀HNO3分别与Cu反应比较浓、稀HNO3的氧化性强弱 | |
| B. | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 说明一种沉淀能转化为另一种溶解度更小的沉淀 | |
| C. | 测定等浓度的HCl、HNO3两溶液的pH 比较Cl、N的非金属性强弱 | |
| D. | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 研究浓度对反应速率的影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com