
”¾ĢāÄæ”æ×čČ¼¼ĮÓÖ³Ę·Ą»š¼Į£¬Ö÷ŅŖÓĆÓŚŃÓ³Ł»ņ·ĄÖ¹æÉČ¼ĪļµÄČ¼ÉÕ”£øł¾Ż×é³É£¬×čČ¼¼ĮæÉ·ÖĪŖĀ±Ļµ×čČ¼¼Į”¢ĪŽ»ś×čČ¼¼ĮµČ”£
£Ø1£©Ā±Ļµ×čČ¼¼Į¶ąĪŖÓŠ»śĀČ»ÆĪļŗĶÓŠ»śäå»ÆĪļ£¬ŹÜČČ»į·Ö½ā²śÉśĀ±»ÆĒā£ØHX£©£¬Ęšµ½×čČ¼×÷ÓĆ”£Ā±»ÆĒāµÄµē×ÓŹ½ĪŖ____£»HF”¢HCl”¢HBr”¢HIĖÄÖÖĀČ»ÆĒāµÄ·ŠµćÓÉøßµ½µĶµÄĖ³ŠņŹĒ___”£
£Ø2£©äåĄė×ÓµÄ×īĶā²ćµē×ÓÅŲ¼Ź½ŹĒ___£»ĀČŌ×ÓµÄŗĖĶāµē×ÓŌĘÓŠ___ÖÖÉģÕ¹·½Ļņ”£
£Ø3£©ĻĀĮŠÄÜĖµĆ÷ĀȵķĒ½šŹōŠŌĒæÓŚäåµÄŹĀŹµŹĒ___£ØŃ”Ģī±ąŗÅ£©”£
a£®HClOĖįŠŌĒæÓŚHBrO
b£®HBrµÄ·Ö½āĪĀ¶ČµĶÓŚHCl
c£®Ļņäå»ÆŃĒĢśČÜŅŗÖŠµĪČėÉŁĮæĀČĖ®£¬ČÜŅŗŃÕÉ«±ä»Ę
d£®BrCl+H2O ”śHBrO+HClŹĒ·ĒŃõ»Æ»¹Ō·“Ó¦
ĪŽ»ś×čČ¼¼ĮÖŠ£¬ĒāŃõ»ÆĀĮŗĶĒāŃõ»ÆĆ¾Į½ÖÖ×čČ¼¼ĮÕ¼¾Ż×ÅÖŲŅŖĪ»ÖĆ”£Į½ÕßµÄ×čČ¼»śĄķ¶¼ŹĒŌŚ“ļµ½ČČ·Ö½āĪĀ¶ČŹ±ŃøĖŁ·Ö½āĪŖŃõ»ÆĪļÓėĖ®£¬Ęšµ½ĪüČČ½µĪĀµÄ×÷ÓĆ”£
£Ø4£©Š“³öĒāŃõ»ÆĀĮŌŚĖįŠŌČÜŅŗÖŠµÄµēĄė·½³ĢŹ½___”£
£Ø5£©Į½ÖÖ×čČ¼¼ĮµÄ·Ö½ā²śĪļŌŚ×ŌČ»½ēÖŠ×īÓŠæÉÄܳÉĪŖŌ×Ó¾§ĢåµÄŹĒ___”££ØĢī»ÆѧŹ½£©
£Ø6£©ĪŽĖ®Ģ¼ĖįĆ¾Ņ²ŹĒŅ»ÖÖŠĀŠĶĪŽ»ś×čČ¼¼Į£¬³żĮĖ¾ßÓŠµ„Ī»ÖŹĮæĪüČČĮæøü“óµÄĢŲµćĶā£¬»¹ÄÜŹĶ·Å¾ßÓŠĆš»š×÷ÓƵÄĘųĢ唣Š“³öøĆĘųĢåµÄ½į¹¹Ź½___”£
£Ø7£©ÓėĆ¾Ąė×ÓŗĖĶāµē×ÓÅŲ¼ĻąĶ¬µÄĮķĶāĮ½øöŃōĄė×ӵİė¾¶“󊔹ŲĻµĪŖ___£ØĢīĪ¢Į£·ūŗÅ£©”£
”¾“š°ø”æ![]() HF£¾HI£¾HBr£¾HCl 4s24p6 4 bd Al(OH)3
HF£¾HI£¾HBr£¾HCl 4s24p6 4 bd Al(OH)3![]() Al3++3OH- Al2O3 O=C=O Na+>Al3+
Al3++3OH- Al2O3 O=C=O Na+>Al3+
”¾½āĪö”æ
(1)Ā±ĖŲŌ×ÓµÄ×īĶā²ćµē×ÓŹż¾łĪŖ7øö£¬Ā±»ÆĒā¾łĪŖ¹²¼ŪŠĶ·Ö×Ó£¬ĒŅHF·Ö×Ó¼ä“ęŌŚĒā¼ü£»
(2)äåŌ×ÓŗĖµēŗÉŹżĪŖ35£»ĀČŌ×ÓµÄŗĖĶāµē×ÓÅŲ¼Ź½ĪŖ1s22s22p63s23p5£»
(3)ŌŖĖŲµÄ·Ē½šŹōŠŌŌ½Ē棬Ę䵄֏µÄŃõ»ÆŠŌŌ½Ē攢Ęä×īøß¼ŪŃõ»ÆĪļµÄĖ®ŗĻĪļĖįŠŌŌ½Ē攢ĘäĒā»ÆĪļµÄĪČ¶ØŠŌŌ½Ē攢Ę䵄֏ÓėĒāĘų»ÆŗĻŌ½ČŻŅ×”¢Ęä¶Ō¼üŗĻµ„ÖŹµÄĪüŅżĮ¦Ō½“ó£»
(4)ĒāŃõ»ÆĀĮŹĒĮ½ŠŌĒāŃõ»ÆĪļ£¬ÄÜÓėĖį·“Ӧɜ³ÉŃĪŗĶĖ®£»
(5)ĒāŃõ»ÆĀĮŗĶĒāŃõ»ÆĆ¾µÄ·Ö½ā²śĪļ³żĖ®Ķā£¬»¹ÓŠAl2O3ŗĶMgO£¬ĘäÖŠMgµÄ½šŹōŠŌ±ČAlµÄ½šŹōŠŌ»īĘĆ£»
(6)Ģ¼ĖįĆ¾øßĪĀ·Ö½āÉś³ÉMgOŗĶCO2£¬ĘäÖŠCO2ŹĒÖ±ĻߊĶ·Ē¼«ŠŌ·Ö×Ó£»
(7)ÓėĆ¾Ąė×ÓŗĖĶāµē×ÓÅŲ¼ĻąĶ¬µÄĮķĶāĮ½øöŃōĄė×ÓĪŖNa+ŗĶAl3+£¬ŗĖµēŗÉŹż“ó£¬Ąė×Ó°ė¾¶Š””£
(1)Ā±ĖŲŌ×ÓµÄ×īĶā²ćµē×ÓŹż¾łĪŖ7øö£¬Ā±»ÆĒāÖŠHŗĶXÖ®¼ä“ęŌŚŅ»øö¹²ÓƵē×Ó¶Ō£¬ŌņHXµÄµē×ÓŹ½ĪŖ![]() £¬HX¾łĪŖ¹²¼ŪŠĶ·Ö×Ó£¬Ļą¶Ō·Ö×ÓÖŹĮæŌ½“󣬷Ö×Ó¼ä×÷ÓĆĮ¦Ō½“󣬷ŠµćŌ½øߣ¬µ«HF·Ö×Ó¼ä“ęŌŚĒā¼ü£¬Ęä·Šµć±ČĘäĖüHXøߣ¬ŌņHF”¢HCl”¢HBr”¢HIĖÄÖÖĀČ»ÆĒāµÄ·ŠµćÓÉøßµ½µĶµÄĖ³ŠņŹĒHF£¾HI£¾HBr£¾HCl£»
£¬HX¾łĪŖ¹²¼ŪŠĶ·Ö×Ó£¬Ļą¶Ō·Ö×ÓÖŹĮæŌ½“󣬷Ö×Ó¼ä×÷ÓĆĮ¦Ō½“󣬷ŠµćŌ½øߣ¬µ«HF·Ö×Ó¼ä“ęŌŚĒā¼ü£¬Ęä·Šµć±ČĘäĖüHXøߣ¬ŌņHF”¢HCl”¢HBr”¢HIĖÄÖÖĀČ»ÆĒāµÄ·ŠµćÓÉøßµ½µĶµÄĖ³ŠņŹĒHF£¾HI£¾HBr£¾HCl£»
(2)äåŌ×ÓŗĖµēŗÉŹżĪŖ35£¬ŌņäåĄė×ÓµÄ×īĶā²ćµē×ÓÅŲ¼Ź½ĪŖ4s24p6£»ĀČŌ×ÓµÄŗĖĶāµē×ÓÅŲ¼Ź½ĪŖ1s22s22p63s23p5£¬¹²ÓŠ1s”¢2s”¢2p”¢3s”¢3p4øöÄܼ¶£¬ÓÖs¹ģµĄÓŠ1ÖÖ²»Ķ¬µÄÉģÕ¹·½Ļņ£¬p¹ģµĄÓŠ3ÖÖ²»Ķ¬µÄÉģÕ¹·½Ļņ£¬ĖłŅŌĀČŌ×Ó¹²ÓŠ4ÖÖ²»Ķ¬µÄÉģÕ¹·½Ļņ£»
(3)a£®ŌŖĖŲµÄ·Ē½šŹōŠŌŌ½Ē棬Ęä×īøß¼ŪŃõ»ÆĪļµÄĖ®ŗĻĪļĖįŠŌŌ½Ē棬µ«HClOŗĶHBrO¾ł²»ŹĒ×īøß¼ŪŃõ»ÆĪļµÄĖ®ŗĻĪļ£¬ŌņĪŽ·Øøł¾ŻHClOĖįŠŌĒæÓŚHBrOÅŠ¶Ļ·Ē½šŹōŠŌCl£¾Br£¬¹Źa“ķĪó£»
b£®HBrµÄ·Ö½āĪĀ¶ČµĶÓŚHCl£¬ĖµĆ÷HBr½Ļ²»ĪČ¶Ø£¬ŌņæÉĖµĆ÷ĀȵķĒ½šŹōŠŌĒæÓŚä壬¹ŹbÕżČ·£»
c£®ĻņFeBr2ČÜŅŗÖŠµĪ¼ÓÉŁĮæĀČĖ®£¬»¹ŌŠŌ£ŗFe2+£¾Br-£¬ÉŁĮæĀČĘųĻČŃõ»ÆFe2+Éś³ÉFe3+£¬Fe3+ŌŚČÜŅŗÖŠ³ŹĻÖĒ³»ĘÉ«£¬²»ÄÜÖ¤Ć÷ĀȵķĒ½šŹōŠŌĒæÓŚä壬¹Źc“ķĪó£»
d£®BrCl+H2O ”śHBrO+HClŹĒ·ĒŃõ»Æ»¹Ō·“Ó¦ĖµĆ÷²»“ęŌŚŌŖĖŲ»ÆŗĻ¼ŪµÄ±ä»Æ£¬ŌņBrClÖŠĀČŌŖĖŲĪŖ-1¼Ū£¬æÉÖŖĀČŌ×ÓĪüŅżµē×ÓÄÜĮ¦Ē棬¼“ĀČŌŖĖŲµÄ·Ē½šŹōŠŌĒæÓŚä壬¹ŹdÕżČ·£»
¹Ź“š°øĪŖbd£»
(4)ĒāŃõ»ÆĀĮŹĒĮ½ŠŌĒāŃõ»ÆĪļ£¬ÄÜÓėĖį·“Ӧɜ³ÉŃĪŗĶĖ®£¬ĻŌ¼īŠŌ£¬ŌņĒāŃõ»ÆĀĮŌŚĖįŠŌČÜŅŗÖŠµÄµēĄė·½³ĢŹ½ĪŖAl(OH)3![]() Al3++3OH-£»
Al3++3OH-£»
(5)ĒāŃõ»ÆĀĮŗĶĒāŃõ»ÆĆ¾µÄ·Ö½ā²śĪļ³żĖ®Ķā£¬»¹ÓŠAl2O3ŗĶMgO£¬ŅņMgµÄ½šŹōŠŌ±ČAlµÄ½šŹōŠŌĒ棬ŌņŌŚ×ŌČ»½ēÖŠ×īÓŠæÉÄܳÉĪŖŌ×Ó¾§ĢåµÄŹĒAl2O3£»
(6)Ģ¼ĖįĆ¾øßĪĀ·Ö½āÉś³ÉMgOŗĶCO2£¬ĘäÖŠCO2ŹĒÖ±ĻߊĶ·Ē¼«ŠŌ·Ö×Ó£¬Ęä½į¹¹Ź½ĪŖO=C=O£»
(7)ÓėĆ¾Ąė×ÓŗĖĶāµē×ÓÅŲ¼ĻąĶ¬µÄĮķĶāĮ½øöŃōĄė×ÓĪŖNa+ŗĶAl3+£¬ŗĖµēŗÉŹż“ó£¬Ąė×Ó°ė¾¶Š”£¬ŌņĮ½ŃōĄė×ӵİė¾¶“󊔹ŲĻµĪŖNa+>Al3+”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ2019 ÄźÅµ±“¶ū»Æѧ½±ŹŚÓčĮĖŌŚļ®Ąė×Óµē³ŲĮģÓņ×÷³öĶ»³ö¹±Ļ×µÄČżĪ»æĘѧ¼Ņ”£Ņ»Ąąļ®Ąė×Óµē³ŲµÄµē³Ų×Ü·“Ó¦ĪŖLix C6 £«Li1-xY![]() C6 (ŹÆÄ«)+LiY ”£ŅŃÖŖµē×ÓµēĮæĪŖ1.6 ”Į10£19 C £¬ĻĀĮŠ¹ŲÓŚÕāĄąµē³ŲµÄĖµ·ØÖŠ“ķĪóµÄŹĒ
C6 (ŹÆÄ«)+LiY ”£ŅŃÖŖµē×ÓµēĮæĪŖ1.6 ”Į10£19 C £¬ĻĀĮŠ¹ŲÓŚÕāĄąµē³ŲµÄĖµ·ØÖŠ“ķĪóµÄŹĒ
A.½šŹōļ®µÄ¼Ūµē×ÓĆܶČŌ¼ĪŖ 13760 C/gB.“ÓÄÜĮæ½Ē¶Čæ“ĖüĆĒ¶¼ŹōÓŚŠīµē³Ų
C.ŌŚ·ÅµēŹ±ļ®ŌŖĖŲ·¢ÉśĮĖ»¹Ō·“Ó¦D.ŌŚ³äµēŹ±ļ®Ąė×Ó½«Ē¶ČėŹÆÄ«µē¼«
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŅ©ĪļÖŠ¼äĢåµÄŗĻ³ÉĀ·ĻßČēĻĀ£ŗ
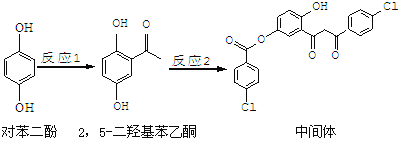
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A.¶Ō±½¶ž·ÓŗĶ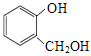 »„ĪŖĶ¬ĻµĪļ
»„ĪŖĶ¬ĻµĪļ
B.1 moløĆÖŠ¼äĢå×ī¶ąæÉÓė7 molĒāŃõ»ÆÄĘ·“Ó¦
C.2£¬5”Ŗ¶žōĒ»ł±½ŅŅĶŖÄÜ·¢Éś¼Ó³É”¢Ė®½āµČ·“Ó¦
D.øĆÖŠ¼äĢå·Ö×Óŗ¬ÓŠōŹ»łŗĶōĒ»łĮ½ÖÖŗ¬Ńõ¹ŁÄÜĶÅ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŹōÓŚŃõ»Æ»¹Ō·“Ó¦µÄŹĒ( )
A.MgCl2 + Ba(OH)2 == BaCl2 + Mg(OH)2”żB.CO2 + 2NaOH == Na2CO3 + H2O
C.CaCO3 ![]() CaO + CO2ӟD.H2 + CuO ==H2O + Cu
CaO + CO2ӟD.H2 + CuO ==H2O + Cu
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æµŖ»ÆÅš£ØBN£©ŹĒŅ»ÖÖÖŲŅŖµÄ¹¦ÄÜĢՓɲÄĮĻ”£ŅŌĢģČ»ÅšÉ°ĪŖĘšŹ¼Īļ£¬¾¹żŅ»ĻµĮŠ·“Ó¦æÉŅŌµĆµ½BF3ŗĶBN£¬ČēĶ¼ĖłŹ¾£ŗ
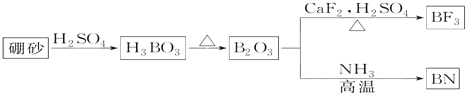
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ÓÉB2O3ÖʱøBF3”¢BNµÄ»Æѧ·½³ĢŹ½ŹĒ___”¢___”£
£Ø2£©»łĢ¬BŌ×ӵĵē×ÓÅŲ¼Ź½ĪŖ___£»BŗĶNĻą±Č£¬·Ē½šŹōŠŌ½ĻĒæµÄŹĒ___£¬BNÖŠBŌŖĖŲµÄ»ÆŗĻ¼ŪĪŖ___£»
£Ø3£©ŌŚBF3·Ö×ÓÖŠ£¬F©B©FµÄ¼ü½ĒŹĒ___£¬øĆ·Ö×ÓĪŖ___·Ö×Ó£ØĢīŠ“”°¼«ŠŌ”± »ņ”°·Ē¼«ŠŌ”±£©£¬BF3ŗĶ¹żĮæNaF×÷ÓĆæÉÉś³ÉNaBF4£¬BF4-ÖŠæÉÄÜŗ¬ÓŠ___£¬Į¢Ģå½į¹¹ĪŖ___£»
£Ø4£©ŌŚÓėŹÆÄ«½į¹¹ĻąĖʵÄĮł·½µŖ»ÆÅš¾§ĢåÖŠ£¬²ćÄŚBŌ×ÓÓėNŌ×ÓÖ®¼äµÄ»Æѧ¼üĪŖ___£¬²ć¼ä×÷ÓĆĮ¦ĪŖ___”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æW”¢X”¢Y”¢Z¾łĪŖ¶ĢÖÜĘŚŌŖĖŲ£¬X”¢WæÉŠĪ³ÉĮ½ÖÖŅŗĢ¬»ÆŗĻĪļ¼×ŗĶŅŅ£¬ĘäŌ×ÓøöŹż±Č·Ö±šĪŖ1”Ć1£Ø¼×£©ŗĶ2”Ć1£ØŅŅ£©£¬ĒŅ·Ö×ÓÖŠµē×Ó×ÜŹż·Ö±šĪŖ18£Ø¼×£©ŗĶ10£ØŅŅ£©”£XÓėZÄÜŠĪ³ÉŅ»ÖÖ¼«Ņ×ČÜÓŚĖ®µÄ¼īŠŌĘųĢå±ūXÓėYÄÜŠĪ³É¼«Ņ×ČÜÓŚĖ®µÄĖįŠŌĘųĢ嶔£¬¶”·Ö×ÓÖŠµÄµē×ÓŹżĪŖ18”£X”¢Y”¢ZÄÜŠĪ³ÉŅ»ÖÖĄė×Ó»ÆŗĻĪļ£¬ĘäĖ®ČÜŅŗ³ŹČõĖįŠŌ”£ĒėŠ“³ö£ŗ
£Ø1£©WµÄŌŖĖŲ·ūŗÅ___£¬ĘäŗĖĶā¹²ÓŠ___ÖÖŌĖ¶ÆדĢ¬²»Ķ¬µÄµē×Ó”£
£Ø2£©¼×ĪļÖŹµÄ½į¹¹Ź½ĪŖ___£»ŅŅĪļÖŹµÄæռ乹ŠĶĪŖ___”£
£Ø3£©ZŌŖĖŲŗĖĶā¹²ÓŠ___ÖÖÄÜĮæ²»Ķ¬µÄµē×Ó£¬¼īŠŌĘųĢå¼×µÄµē×ÓŹ½ĪŖ___”£
£Ø4£©ÓĆĄė×Ó·½³ĢŹ½½āŹĶX”¢Y”¢ZŠĪ³ÉµÄ»ÆŗĻĪļĖ®ČÜŅŗ³ŹČõĖįŠŌµÄŌŅņŹĒ___”£
£Ø5£©īéŌŖĖŲøśYŌŖĖŲÄÜŠĪ³É»ÆŗĻĪļ£ØBiY3£©£¬ĘäĖ®½āÉś³ÉÄŃČÜÓŚĖ®µÄBiOY”£
¢ŁBiY3Ė®½ā·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ___”£
¢Ś°ŃŹŹĮæµÄBiY3ČÜÓŚŗ¬ÓŠÉŁĮ涔µÄĖ®ÖŠ£¬ÄܵƵ½³ĪĒåČÜŅŗ£¬ŹŌ·ÖĪöæÉÄܵÄŌŅņ___”£
¢ŪŅ½Ņ©ÉĻ°ŃBiOY½Š×ö”°“ĪijĖįīé”±£¬·ÖĪöÕāÖÖ½Š·ØµÄ²»ŗĻĄķÖ®“¦£¬ĪŖŹ²Ć“”£___”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĄė×Ó·½³ĢŹ½ÕżČ·µÄŹĒ(””””)
A.ĒāŃõ»Æ±µČÜŅŗÓėĻ”ĮņĖį·“Ó¦:Ba2++S![]() +H++OH-BaSO4”ż+H2O
+H++OH-BaSO4”ż+H2O
B.æĢÖĘÓ”Ė¢µēĀ·°åµÄ·“Ó¦:Fe3++CuFe2++Cu2+
C.ĀČĘųÓėĒāŃõ»ÆÄĘČÜŅŗ·“Ó¦:Cl2+2OH-Cl-+ClO-+H2O
D.Ļ”ĮņĖįµĪµ½ĢśĘ¬ÉĻ:2Fe+6H+2Fe3++3H2”ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀ±ķŹĒŌŖĖŲÖÜĘŚ±ķµÄŅ»²æ·Ö£¬³ż±ź³öµÄŌŖĖŲĶā£¬±ķÖŠµÄĆæøö±ąŗÅ“ś±ķŅ»ÖÖŌŖĖŲ”£Ēėøł¾ŻŅŖĒó»Ų“šĪŹĢā£ŗ
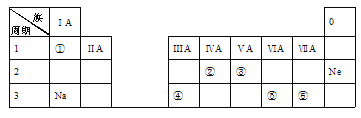
£Ø1£©¢ÜµÄŌ×ÓŠņŹżŹĒ________£»
£Ø2£©¢ŻµÄŌ×Ó½į¹¹Ź¾ŅāĶ¼ŹĒ____________£»
£Ø3£©¢ŚŗĶ¢ŪĮ½ÖÖŌŖĖŲµÄ·Ē½šŹōŠŌĒæČõ¹ŲĻµŹĒ£ŗ¢Ś______¢Ū£ØĢī”°>”±”¢”°<”±»ņ”°=”±£©£»
£Ø4£©¢ŁŗĶ¢ŽĮ½ÖÖŌŖĖŲ×é³ÉµÄ»ÆŗĻĪļÖŠŗ¬ÓŠµÄ»Æѧ¼üŹĒ_____£ØĢī”°¹²¼Ū”±»ņ”°Ąė×Ó”±£©¼ü”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀ±ķŹĒŌŖĖŲÖÜĘŚ±ķµÄŅ»²æ·Ö£¬³ż±ź³öµÄŌŖĖŲĶā£¬±ķÖŠµÄĆæøö±ąŗÅ“ś±ķŅ»ÖÖŌŖĖŲ”£Ēėøł¾ŻŅŖĒó»Ų“šĪŹĢā£ŗ
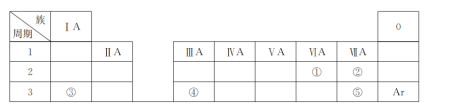
(1)¢ŁµÄŌŖĖŲ·ūŗÅŹĒ________£»
(2)¢ŚŗĶ¢ŻµÄŌ×Ó°ė¾¶“󊔹ŲĻµŹĒ¢Ś________¢Ż(Ģī”°£¾”±”°£¼”±»ņ”°£½”±)£»
(3)¢ŪŗĶ¢ŻŠĪ³ÉµÄ»ÆŗĻĪļŗ¬ÓŠµÄ»Æѧ¼üŹĒ__________(Ģī”°Ąė×Ó¼ü”±»ņ”°¹²¼Ū¼ü”±)£»
(4)¢Ū”¢¢ÜµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļĻą»„·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ_________________________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com