
(10分)已知:a、H+(aq) + OH-(aq) = H2O(l) △H=-57.3 kJ•mol-1;
b、1.6gCH4完全燃烧生成水蒸气时放热80.2kJ,1g水蒸气转化成液态水放热2.444kJ。
(1)氢氧化钠与硫酸两稀溶液发生反应,写出表征其中和热的热化学方程式:
(2)写出表征甲烷燃烧热的热化学方程式:
(3)已知2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
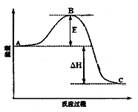
① 图中C表示 E的大小对该反应的反应热有无影响? 。
② 该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(4)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
① Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= ―24.8 kJ•mol-1
② 3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H= ―47.2 kJ•mol-1
③ Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5 kJ•mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________________________________________。
(10分)
(1) NaOH(aq) +1/2H2SO4 (aq) = 1/2Na2SO4(aq) +H2O(l) △H=-57.3 kJ•mol-1(2分)
(2) CH4(g)+2O2(g)=CO2(g)+2 H2O(l) △H= ―889.98 kJ•mol-1(2分)
(3) ① 生成物能量 无 (各1分,共2分)
② 降低 因为催化剂改变了反应的历程使活化能E降低 (各1分,共2分)
(4) FeO(s)+ CO(g)== Fe(s)+CO2(g) △H=-218.0 kJ•mol-1 (2分)
【解析】(1)考查热化学方程式的书写。中和热是在一定条件下,在稀溶液中,酸和碱反应生成1mol水时放出的热量,所以该反应的热化学方程式是 NaOH(aq) +1/2H2SO4 (aq) = 1/2Na2SO4(aq) +H2O(l) △H=-57.3 kJ•mol-1。
(2)燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以该反应的热化学方程式是CH4(g)+2O2(g)=CO2(g)+2 H2O(l) △H=―889.98 kJ•mol-1。
(3)①根据图像可知,C点表示生成物的总能量。E表示反应的活化能,活化能的大小不能改变反应的反应热。
②催化剂改变了反应的历程使活化能E降低,所以B点降低。
(4)考查反应热的计算。根据盖斯定律可知,(①×3-②-③×2)÷6即得到
FeO(s)+ CO(g)== Fe(s)+CO2(g),所以反应热是△H=()―24.8 kJ•mol-1×3+47.2 kJ•mol-1-640.5 kJ•mol-1×2)=-218.0 kJ•mol-1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2012届安徽省黄山市高三七校联考化学试卷 题型:填空题
(14分)X、Y、Z、W是元素周期表中前四周期的常见元素,其相关信息如下表;
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 原子最外层电子数是次外层的三倍 |
| Z | 单质及其化合物的焰色反应为黄色 |
| W | W元素基态原子的M层全充满,N层只有一个电子 |
 。X的一种单质熔点很高,硬度很大,则这种单质的晶体属于 晶体。
。X的一种单质熔点很高,硬度很大,则这种单质的晶体属于 晶体。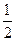 O2(g) ="=" H2O(l) ΔH= -285.8kJ·mol-1
O2(g) ="=" H2O(l) ΔH= -285.8kJ·mol-1查看答案和解析>>
科目:高中化学 来源:2012-2013学年天津市武清区杨村一中高二第一次月考化学试卷(带解析) 题型:填空题
(10分)已知:a、H+(aq) + OH-(aq) = H2O(l) △H=-57.3 kJ?mol-1;
b、1.6gCH4完全燃烧生成水蒸气时放热80.2kJ,1g水蒸气转化成液态水放热2.444kJ。
(1)氢氧化钠与硫酸两稀溶液发生反应,写出表征其中和热的热化学方程式:
(2)写出表征甲烷燃烧热的热化学方程式:
(3)已知2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题: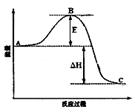
①图中C表示 E的大小对该反应的反应热有无影响? 。
②该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(4)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=―24.8 kJ?mol-1
② 3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H=―47.2 kJ?mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5 kJ?mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽省黄山市高三七校联考化学试卷 题型:填空题
(14分)X、Y、Z、W是元素周期表中前四周期的常见元素,其相关信息如下表;
|
元素 |
相关信息 |
|
X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
|
Y |
原子最外层电子数是次外层的三倍 |
|
Z |
单质及其化合物的焰色反应为黄色 |
|
W |
W元素基态原子的M层全充满,N层只有一个电子 |
⑴ X位于元素周期表第 族。X的一种单质熔点很高,硬度很大,则这种单质的晶体属于 晶体。
⑵ X与Y中电负性较强的是(填元素符号) ;XY2的电子式是 ,分子中存在 个σ键。
⑶Z2Y2中含有的化学键类型有 。阴、阳离子的个数比为 。
⑷W的基态原子核外电子排布式是 。
⑸废旧印刷电路板上有W的单质A。用H2O2和H2SO4的混合溶液可溶出印刷电路板上的A。已知:
A(s)+H2SO4 (aq) == ASO4(aq) + H2(g) ΔH=+64.4kJ·mol-1
2H2O2(l) == 2H2O(l) + O2(g) ΔH= -196.4kJ·mol-1
H2(g)+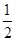 O2(g) == H2O(l) ΔH= -285.8kJ·mol-1
O2(g) == H2O(l) ΔH= -285.8kJ·mol-1
请写出A与H2SO4、H2O2反应生成ASO4(aq)和H2O(l)的热化学方程式(A用化学式表示):
。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年贵州省高三五校第五次联考(理综)化学部分 题型:选择题
下列有关热化学方程式的叙述正确的是
A.已知:正丁烷稳定性小于异丁烷,则CH3CH2CH2CH3(g)→(CH3)2CHCH3(g);△H>0
B.已知:
OH-(ag)+H+(aq) H2O(l);△H=-57.4 kJ/mol
H2O(l);△H=-57.4 kJ/mol
则含20.0g NaOH的稀溶液与稀醋酸完全中和,放出28.7kJ的热量;
C.已知:2H2O(l) 2H2(g)+O2(g);△H= +483.6
kJ· mol—1,则氢气的燃烧热为241.8kJ/mol
2H2(g)+O2(g);△H= +483.6
kJ· mol—1,则氢气的燃烧热为241.8kJ/mol
D.己知:2C(s)+2O2(g)=2CO2(g);△H1 2C(s)+O2(g)=2CO(g);△H2,则△H1>△H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com