
【题目】以硫铁矿(主要成分为FeS2)为原料制备硫酸亚铁晶体(FeSO4xH2O)的工艺流程如下:
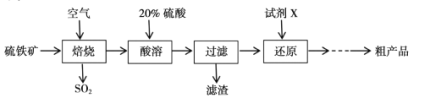
(1)已知焙烧后得到的固体主要成分为Fe2O3。写出焙烧过程主要反应的化学方程式____。
(2)写出酸溶过程主要反应的离子方程式____。
(3)试剂X是(写化学式)____。
(4)从还原得到的溶液中获得硫酸亚铁晶体(FeSO4xH2O)的操作是____
(5)利用如图装置测定FeSO4xH2O中结晶水含量:
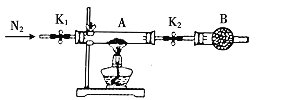
实验前通入N2,的主要目的是____,装置B中盛放的试剂是____。
【答案】4FeS2+11O2![]() 2Fe2O3+8SO2 Fe2O3+6H+=2Fe3++3H2O Fe 蒸发浓缩、冷却结晶、过滤、洗涤、干燥 排出装置的氧气,可避免硫酸亚铁被氧化 碱石灰
2Fe2O3+8SO2 Fe2O3+6H+=2Fe3++3H2O Fe 蒸发浓缩、冷却结晶、过滤、洗涤、干燥 排出装置的氧气,可避免硫酸亚铁被氧化 碱石灰
【解析】
(1)焙烧过程是硫化亚铁与氧气的反应,生成三氧化二铁和二氧化硫;
(2)酸溶是三氧化二铁与硫酸的反应;
(3)试剂X是还原剂,其作用是将Fe3+还原为Fe2+,为避免引入新的杂质,X是铁粉;
(4)溶液中获得硫酸亚铁晶体(FeSO4xH2O)的方法是蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(5)硫酸亚铁易被氧化,通入氮气排出装置的氧气,干燥管中加入碱石灰可避免空气的水进入A装置。
(1)高温条件下FeS2与氧气反应生成Fe2O3与SO2,该反应的化学方程式为:4FeS2+11O2![]() 2 Fe2O3+8SO2;
2 Fe2O3+8SO2;
(2)酸溶是三氧化二铁与硫酸反应的过程,化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,离子方程式为Fe2O3+6H+=2Fe3++3H2O;
(3)试剂X是还原剂,其作用是将Fe3+还原为Fe2+,为避免引入新的杂质,X是铁粉;
(4)还原得到的溶液的主要溶质是FeSO4,从中获得硫酸亚铁晶体(FeSO4xH2O)的操作是:蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(5)FeSO4xH2O加热分解可以得到硫酸亚铁和水,由于亚铁离子不稳定,易被氧气氧化,故实验前需赶走空气,B中应该盛放干燥剂碱石灰,防止空气和水蒸气进入,使亚铁离子被氧化,或者防止亚铁离子水解。


科目:高中化学 来源: 题型:
【题目】1,![]() 二异丙烯基苯是工业上常用的交联剂,可用于制备高性能超分子聚合物,其结构如图所示。下列有关1,
二异丙烯基苯是工业上常用的交联剂,可用于制备高性能超分子聚合物,其结构如图所示。下列有关1,![]() 二异丙烯基苯的说法错误的是( )
二异丙烯基苯的说法错误的是( )
A.分子式为![]()
B.能使溴水和高锰酸钾溶液褪色,但反应原理不同
C.分子中所有碳原子不可能处于同一平面
D.其一氯代物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的位置如右图所示, B、C两元素的原子序数之和是A元素原子序数的4倍,各元素对应的物质相互比较,其中关系正确的是

A.原子半径:C>D>AB.单质的熔点:B>C,D>A
C.最高正价:B>D=A>CD.气态氢化物的稳定性:B>C,D>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)铅蓄电池是典型的二次电池,电池总反应式为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。请回答下列问题(不考虑氢、氧的氧化还原):放电时,正极的电极反应式是____________________________。当外电路通过1 mol电子时,理论上负极板的质量增加______g。
2PbSO4+2H2O。请回答下列问题(不考虑氢、氧的氧化还原):放电时,正极的电极反应式是____________________________。当外电路通过1 mol电子时,理论上负极板的质量增加______g。
(二)某研究性学习小组,为了探究电极与原电池的电解质之间关系,设计了下列实验方案:用铝片、铜片、镁片作电极,分别与下列溶液构成原电池,并接电流表。
(1)若用HNO3(浓)作电解质溶液,电极为铜片和铝片,正极上发生的电极反应式为________________;
(2)若电解质溶液为0.5mol/LNaOH溶液,电极为镁片和铝片,则负极的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.按照系统命名法,烃分子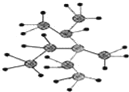 的名称为2,3﹣二甲基﹣3﹣乙基戊烷
的名称为2,3﹣二甲基﹣3﹣乙基戊烷
B.鸡蛋白、大豆蛋白等蛋白质可溶于水,在这些蛋白质溶液中加入(NH4)2SO4或Na2SO4的浓溶液,可使蛋白质的溶解度降低而析出
C.![]() 可发生加成反应、取代反应、氧化反应
可发生加成反应、取代反应、氧化反应
D.有机物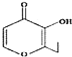 (俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应
(俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中各组物质不能实现如图所示转化的是
![]()
选项 | 甲 | 乙 | 丙 |
A | CO2 | NaHCO3 | Na2CO3 |
B | AlCl3 | Al2O3 | NaAlO2 |
C | AlCl3 | Al | Al(OH)3 |
D | AlCl3 | Al(OH)3 | NaAlO2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表中的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | E | F | H | J | ||||
3 | B | C | D | G | I |
根据A~J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是________,氧化性最强的单质是________,还原性最强的单质是________。
(2)最高价氧化物对应的水化物中,碱性最强的是________,酸性最强的是________,呈两性的是________。
(3)A分别与E、F、G、H、I形成的简单气态化合物中,最稳定的是________。
(4)在B、C、D、G、I中,原子半径最大的是________。
(5)元素C与I形成的化合物的电子式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) ![]() 2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
A. 平衡常数K值越大,X的转化率越大
B. 达到平衡时,反应速率v正(X)=2v逆(Z)
C. 达到平衡后降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D. 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(g)+ nB![]() pC(g)+qD(g)中,A和D都是无色气体,达到平衡后,下列叙述正确的是( )
pC(g)+qD(g)中,A和D都是无色气体,达到平衡后,下列叙述正确的是( )
A.若增加B的量,平衡体系颜色加深,说明B必是气体
B.增大压强,平衡不移动,说明m+n一定等于p+q
C.升高温度,A的转化率减小,说明正反应是吸热反应
D.若B是气体,增大A的量,A、B的转化率都增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com