
| 元素代号 | X | Y | Z | M | N | P |
| 原子半径/nm | 0.186 | 0.143 | 0.075 | 0.074 | 0.152 | 0.099 |
| 元素的主要化合价 | +1 | +3 | +5、-3 | -2 | +1 | +7、-1 |
| A. | X、N元素的金属性:X>N | |
| B. | Y、M元素形成的离子化合物是工业冶炼Y的原料 | |
| C. | X单质在M单质中燃烧生成的化合物39g中共含有0.5NA个阴离子 | |
| D. | 表中Z元素的最高价氧化物的水化物的分子式可表示为H3ZO4 |
分析 短周期元素中,P有+7、-1价,则P为Cl;M有-2价,处于VIA族,原子半径小于Cl,故M为O元素;Z有+5、-3价,处于VA族,原子半径小于Cl,则Z为N元素;Y有+3价,原子半径大于Cl,故Y为Al;X、N均有+1价,处于IA族,原子半径X>N>Al,故X为Na、N为Li.
解答 解:短周期元素中,P有+7、-1价,则P为Cl;M有-2价,处于VIA族,原子半径小于Cl,故M为O元素;Z有+5、-3价,处于VA族,原子半径小于Cl,则Z为N元素;Y有+3价,原子半径大于Cl,故Y为Al;X、N均有+1价,处于IA族,原子半径X>N>Al,故X为Na、N为Li.
A.同主族自上而下金属性减弱,故金属性X(Na)>N(Li),故A正确;
B.Y、M元素形成的离子化合物是氧化铝,工业上电解熔融的氧化铝冶炼Al,故B正确;
C.X单质在M单质中燃烧生成的化合物为Na2O2,由钠离子与过氧根离子构成,39g过氧化钠物质的量为0.5mol,共含有0.5NA个阴离子,故C正确;
D.表中Z元素的最高价氧化物的水化物的分子式可表示为HNO3,故D错误.
故选:D.
点评 本题考查结构性质位置关系应用,根据化合价及原子半径推断元素是解题关键,注意对元素周期律的理解掌握.


科目:高中化学 来源: 题型:解答题
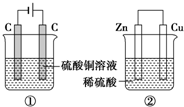 如图两个装置,工作时转移的电子数相等,反应完成后往①中加入19.6gCu(OH)2固体,溶液恰好能恢复到电解前的浓度和体积.若忽略溶液体积的变化,则:
如图两个装置,工作时转移的电子数相等,反应完成后往①中加入19.6gCu(OH)2固体,溶液恰好能恢复到电解前的浓度和体积.若忽略溶液体积的变化,则:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,Y中含有的化学键类型是共价键.
,Y中含有的化学键类型是共价键.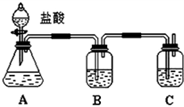
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1471kJ/mol | B. | -1471kJ/mol | C. | 93kJ/mol | D. | -93kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
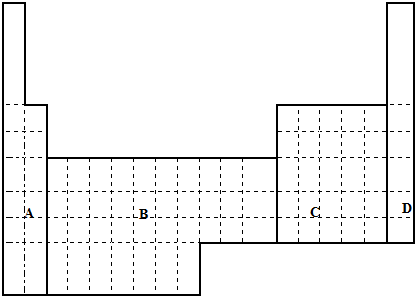
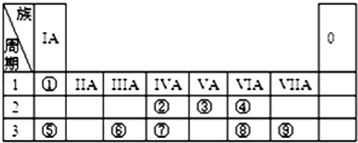
| A. | ①③⑥ | B. | ②④⑥ | C. | ②③④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH的燃烧热为192.9kJ•mol-1 | |
| B. | CH3OH转变成H2的过程一定要吸收能量 | |
| C. | 可推知2H2(g)+O2(g)═2H2O(g)△H=-483.8 kJ/mol | |
| D. | 根据②推知反应:CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H<-192.9kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com