
下列有关实验原理或操作正确的是
A.实验室将硫酸铜溶液直接加热蒸发至干方法来制取CuSO4·5H2O
B.用KSCN溶液检验硫酸亚铁溶液是否氧化变质
C.用湿润的pH试纸来检验溶液的pH值
D.用四氯化碳萃取溴的苯溶液中的溴
科目:高中化学 来源:2014-2015学年天津市河西区高三下学期总复习质量调查一理综化学试卷(解析版) 题型:选择题
下列实验“操作和现象”与“结论”对应关系正确的是
选项 | 操作和现象 | 结论 |
A | CH4和Cl2混合于试管中光照,颜色逐渐褪去 | 二者发生了化合反应 |
B | 微热滴有2滴酚酞的饱和NaHCO3溶液,溶液颜色加深 | NaHCO3受热分解生成了Na2CO3 |
C | 向淀粉溶液中加入20%的硫酸,加热几分钟,冷却后再加入银氨溶液,水浴,没有银镜生成 | 淀粉没发生水解 |
D | 向装有Fe(NO3)2溶液的试管中加入稀硫酸,观察到试管口有红棕色气体产生 | 酸性环境下,NO3-被Fe2+还原为NO,NO遇氧气生成NO2 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省渭南市高三教学质量检测(一模)化学试卷(解析版) 题型:选择题
用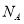 表示阿伏加德罗常数的值。下列叙述中正确的是
表示阿伏加德罗常数的值。下列叙述中正确的是
A.7.8 gNa2S和7.8 gNa2O2 中含有的阴离子的数目均为0.1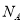
B.相同物质的量的OH-和CH3+含有相同数目的电子
C.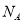 个H2分子与0.5
个H2分子与0.5 个CO分子所占的体积比一定是2:1
个CO分子所占的体积比一定是2:1
D.25℃,pH=13的NaOH溶液中,含有OH- 的数目为0.1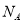
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省六校高三第二次联考理综化学试卷(解析版) 题型:推断题
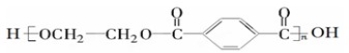
[化学——选修5:有机化学基础](15分)PET是世界上产量最大的合成纤维,其结构简式为:
现以煤的干馏产品A与F为原料制备PET,生产的工艺流程如图所示。其中A为烃,含碳元素的质量分数为90.6%,其蒸气密度是空气密度的3.66倍,且能使酸性高锰酸钾溶液褪色,但不能使溴水褪色。M分子里所有原子共平面。
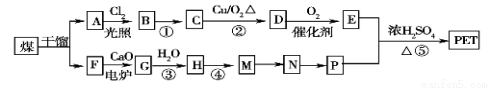
请回答下列问题:
(1)A的名称为________,M→N反应类型为: ________。
(2)反应①的反应条件为:________;
(3)写出有机物A所有一氯代物的结构简式:___________________。
(4)写出下列反应的化学方程式:
Ⅰ.反应②:___________________;
Ⅱ.反应③:____________________;
Ⅲ.D与足量的氢氧化铜悬浊液煮沸:_________________;
Ⅳ.反应⑤:_____________ 。
(5)P的一种同系物X的分子式为C3H8O2,在核磁共振氢谱图中出现三种信号峰,其峰的强度之比为2∶1∶1。则X的结构简式为______。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省六校高三第二次联考理综化学试卷(解析版) 题型:选择题
某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小。已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX—pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系。下列说法错误的是
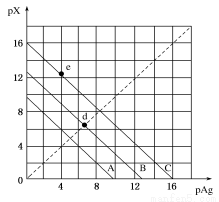
A.e点表示由过量的KI与AgNO3反应产生AgI沉淀
B.A线是AgCl的溶解平衡曲线,C线是AgI的溶解平衡曲线
C.d点是在水中加入足量的AgBr形成的饱和溶液
D.坐标点(8,4)形成的溶液是AgCl的不饱和溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省松原市高一下学期第一次月考化学试卷(解析版) 题型:填空题
填写下列空白(7分):
(1)写出表示含有8个质子、10个中子的原子的化学符号:___________。
(2)周期表中位于第8纵行的铁元素属于第 族。
(3)周期表中最活泼的非金属元素位于第 纵行。
(4)所含元素超过18种的周期是第 、 周期
(5)请写出298K,101KPa时,下列反应的热化学方程式:
用CO(g)还原1mol Fe2O3(s)放热24.8KJ 。
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省松原市高一下学期第一次月考化学试卷(解析版) 题型:选择题
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是
A.X、Y、Z、W的原子半径依次减小
B.W与X形成的化合物中只含离子键
C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
科目:高中化学 来源:2014-2015上海市奉贤区高三第二学期调研测试化学试卷(解析版) 题型:填空题
(本题共11分)氮族元素按原子序数增大,依次为:氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)。请回答:
28.常温常压下,向100mL 1.6mol/L稀氨水中逐滴滴入10mL 4.0mol/L稀硫酸,得到的溶液能使酚酞显红色。请比较所得溶液中NH4+、 NH3﹒H2O、SO42— 三种微粒的物质的量浓度大小关系: 。
29.含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢在热玻璃管中完全分解成氢气和1.50 mg单质砷。则在整个过程中,转移的电子总数为 。
30.铋酸钠(NaBiO3)溶液呈无色。向硫酸锰溶液中依次滴加下列溶液,对应的现象如表所示:
加入溶液 | ①适量铋酸钠溶液 | ②过量的双氧水 | ③适量KI淀粉溶液 |
实验现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 溶液变成蓝色 |
请比较实验中所有的氧化剂和氧化产物的氧化性强弱关系(反应过程中的涉及的气体均不参与比较): 。
31.五氟化锑(SbF5)是无色黏稠液体,是很强的具有特殊酸性的酸,而且是超强酸氟锑酸HSbF6(目前酸性最强的酸,比纯硫酸强2×1019倍)的组分之一。SbF5可用于制备一般化学方法很难制备的氧化性极强的F2,其过程如下(均未配平):
①KMnO4 + KF + H2O2 + HF → K2MnF6 +O2 + H2O
②SbCl5 + HF → SbF5 + HCl
③K2MnF6 + SbF5 → KSbF6 + MnF3 + F2↑
反应①中氧化剂和被氧化的元素的物质的量之比为 ____;反应③中SbF5表现的性质为 ______性。
32.能在一定程度上抵消、减轻外加强酸或强碱对溶液酸度的影响,从而保持溶液的pH值相对稳定。这种溶液称为缓冲溶液。例如:人体血液中HCO3—和H2CO3等微粒形成的平衡体系,使得血液pH能稳定在7.4±0.05。某同学取19ml 0.2mol/L的NaH2PO4溶液,81ml 0.2mol/L的Na2HPO4溶液混合,配制0.2mol/L PH=7.4的磷酸缓冲溶液。已知该缓冲溶液利用的平衡体系是:H2PO4— H++HPO42—,请根据该平衡体系分析其缓冲原理: 。
H++HPO42—,请根据该平衡体系分析其缓冲原理: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省肥城市高三二模理综化学试卷(解析版) 题型:填空题
(18分)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇:
CO (g)+2H2 (g) CH3OH (g)
CH3OH (g)
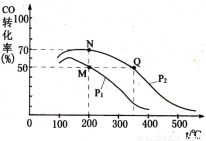
(1)在容积固定为2 L的密闭容器内充入1 mol CO和2 mol H2,加入 催化剂后在250 ℃开始反应,
CO的平衡转化率与温度、压强的关系如图所示。容器中M、N两点气体的物质的量之比为 。M、N、Q三点的平衡常数KM、KN、KQ的大小关系为 。
(2)通过压力计监测上述容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/Mpa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
则从反应开始到20min时,以CO表示的平均反应速率为 ,该温度下平衡常数K= 。
(3)下列描述中能说明上述反应已达平衡状态的是 。
A.2v(H2)正=v(CH3OH)逆
B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变
D.单位时间内生成n mol CO的同时生成2n mol H2
(4)25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源电解300 mL NaCl溶液,正极反应式为 。在电解一段时间后,NaCl溶液的pH变为13(假设NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com