
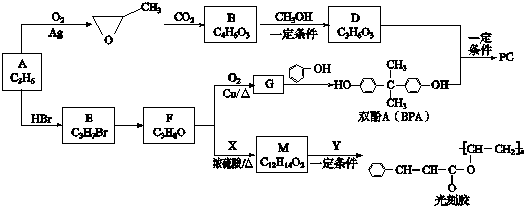
 .
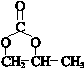
.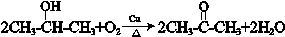 .
.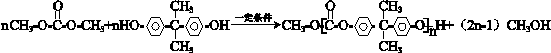 .
.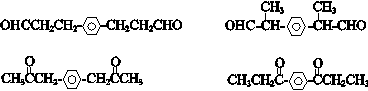 (其中一种).
(其中一种).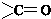 结构
结构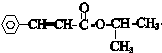 +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$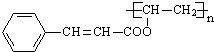 +nCH3CHOHCH3.
+nCH3CHOHCH3. 分析 A为链状结构,根据A的分子式可知,A为CH3CH=CH2,丙烯被氧气氧化成甲基环氧乙烷,甲基环氧乙烷与二氧化碳反应生成B,B分子中含五元环状结构且有酯基,所以B为
 ,根据M的分子式可知,F与X反应生成M,X为
,根据M的分子式可知,F与X反应生成M,X为 ,M为
,M为 ,M与Y发生酯交换反应可得光刻胶,所以Y为
,M与Y发生酯交换反应可得光刻胶,所以Y为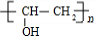 ,据此答题;
,据此答题;
解答 解:A为链状结构,根据A的分子式可知,A为CH3CH=CH2,丙烯被氧气氧化成甲基环氧乙烷,甲基环氧乙烷与二氧化碳反应生成B,B分子中含五元环状结构且有酯基,所以B为
 ,根据M的分子式可知,F与X反应生成M,X为
,根据M的分子式可知,F与X反应生成M,X为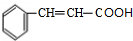 ,M为
,M为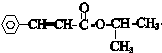 ,M与Y发生酯交换反应可得光刻胶,所以Y为
,M与Y发生酯交换反应可得光刻胶,所以Y为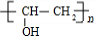 ,
,
(1)A为CH3CH=CH2,A中所含官能团的名称是碳碳双键,
故答案为:碳碳双键;
(2)根据上面的分析可知,B的结构简式 为
故答案为:
(3)根据上面的分析可知,A→E的反应类型为加成反应,E发生水解得F,所以E→F的反应条件为NaOH水溶液,
故答案为:加成反应;NaOH水溶液;
(4)F→G的化学方程式为
故答案为:
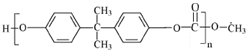
(5)D为CH3OCOOCH3,D与双酚A生成高分子化合物PC的化学方程式为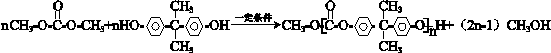
故答案为: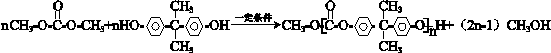
(6)M为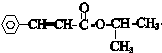 ,根据条件a.苯环上有两个取代基,b.苯环上的一氯代物只有一种,说明苯环上有分布对称的相同基团,c.含有
,根据条件a.苯环上有两个取代基,b.苯环上的一氯代物只有一种,说明苯环上有分布对称的相同基团,c.含有 结构,则符合条件M的同分异构体为
结构,则符合条件M的同分异构体为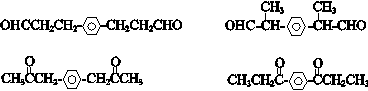
故答案为: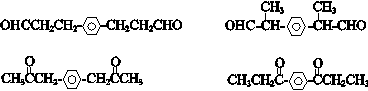
(7)M为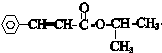 ,Y为
,Y为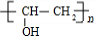 ,M与Y发生酯交换反应可得光刻胶,反应的化学方程式为n
,M与Y发生酯交换反应可得光刻胶,反应的化学方程式为n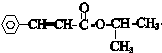 +
+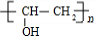 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$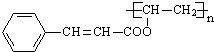 +n CH3CHOHCH3,
+n CH3CHOHCH3,
故答案为:n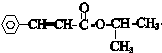 +
+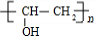 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$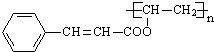 +n CH3CHOHCH3.
+n CH3CHOHCH3.
点评 本题考查有机物的推断与合成,充分利用转化关系中物质的结构及分子式,结合正、逆推法进行推断,较好的考查学生的分析、推理能力,注意掌握官能团的性质与转化,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
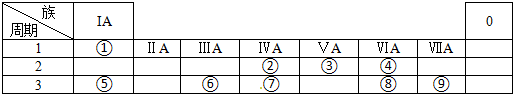
 ,化学键类型有离子键、极性键(填“离子键”“极性键”或“非极性键”).
,化学键类型有离子键、极性键(填“离子键”“极性键”或“非极性键”).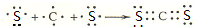 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可作净水剂:Al3++3H2O=Al(OH)3↓+3H+ | |
| B. | 盛装NaOH溶液的试剂瓶不用玻璃塞:SiO2+2NaOH=Na2SiO3+H2O | |
| C. | NaHCO3溶液中加入少量Ca(OH)2溶液,产生白色沉淀:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 电解NaCl溶液,阴极有无色气体逸出,其电极反应式为:2Cl--2e-=Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 农作物收获后,就地焚烧秸秆,增加土壤中钾肥含量 | |
| B. | 工业废水可经过“再生”处理,用于城市道路保洁、喷泉和浇花用水 | |
| C. | 硅单质常作为制备光导纤维的主要材料 | |
| D. | 淘米水中含有淀粉可以直接检测加碘盐中是否含有碘元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L O2和O3的混合气中氧原子数为0.2NA | |
| B. | 标准状况下,22.4 L苯的分子数为NA | |
| C. | 46 g乙醇中含有的共价键总数为8 NA | |
| D. | 1 L 0.1 mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝热剂 | B. | 黑火药 | C. | 木炭 | D. | 丹药(硫化汞) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
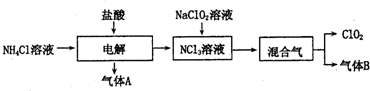
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com